
«Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области»
(М. Горький)
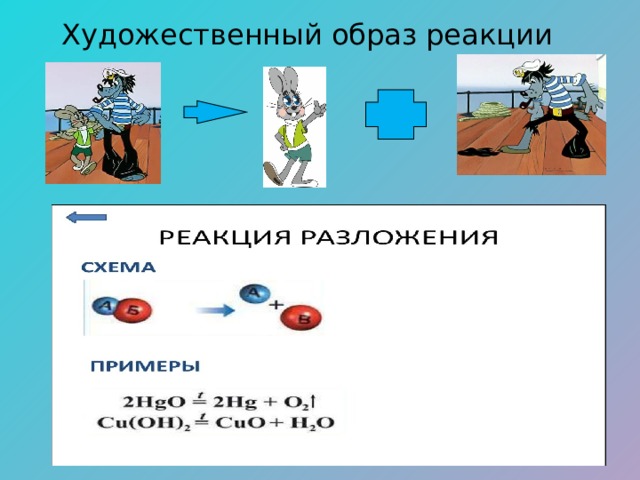
Художественный образ реакции
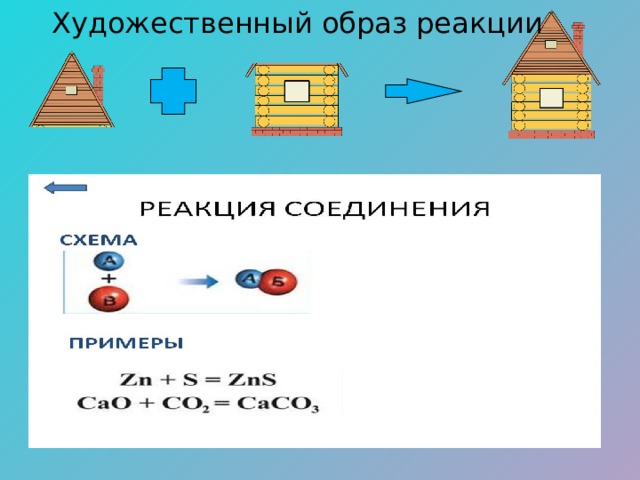
Художественный образ реакции

Художественный образ реакции
Л екарь + П П екарь + Л

«Найди лишнее»
1) Zn + 2HCl → ZnCl 2 + H 2
2) FeCl 3 +3NaOH=Fe(OH) 3 +3NaCl
3) 4P + 5O 2 → 2P 2 O 5
t
4) CaCO 3 → CaO + CO 2

Тема урока:
Реакции обмена

Решаемая проблема:
В чем заключается главная
особенность реакций обмена?
Каковы условия протекания реакций
обмена в растворах до конца?

«Опыт – единственный
верный путь спрашивать
природу и слышать
ответ в её лаборатории»
Д.И. Менделеев

Правила техники безопасности!
- При выполнении опытов следует соблюдать
аккуратность!
2. Нельзя брать и трогать вещества руками
3. Реактива следует наливать в пробирку не более 1-2 мл.
4. Пробирку с реагирующими веществами следует держать на
уровне глаз и над подносом, стоящем на столе
5. Вещества нельзя пробовать на вкус
6. Для ознакомления с запахом вещества нужно
ладонью руки сделать движение от отверстия сосуда к носу
7. После работы с реактивами обязательно помыть руки

Лабораторные опыты
1) NaOH+HCl → NaCl + H 2 O
Реакция нейтрализации
2) BaCl 2 + H 2 SO 4 → 2HCl + BaSO 4 ↓
3) СaCO 3 +2HCl → СаCl 2 + H 2 O+CO 2 ↑

Реакции обмена – это реакции между
двумя сложными веществами,
в ходе которых они
обмениваются своими
составными частями
В результате реакции образуются два новых сложных вещества!

Условия протекания
реакций обмена до конца
Если выделился газ – это раз! И получится вода – это два! А еще нерастворимый осаждается продукт… «Есть осадок», говорим мы – это третий важный пункт!

«Генеральная уборка»
Завтра к нам приезжают гости, и мама объявила генеральную уборку! Мне поручили почистить ванну, раковину и плитку, а там повсюду этот ужасный известковый налёт, и много различных средств. Какое выбрать не знаю! Какое вещество должно содержать чистящее средство, чтобы им можно было отчистить известковый налет?
Ответ: кислота

«Совет садоводу»
На своем участке я часто нахожу среди сорняков хвощ. Это говорит о том, что почва имеет кислую среду. Из-за повышенной кислотности растения часто болеют. Во избежание многих заболеваний садоводы посыпают почву белым, рыхлым порошком – гашеной известью или поливают её раствором.
Вопрос: Для чего садоводы добавляют в почву гашеную известь?
Ответ: для того, чтобы
нейтрализовать кислоту

Домашнее задание
Параграф №32
Среди предложенных реакций выбрать реакции обмена и определить, какие из них будут протекать до конца. В выбранных реакциях расставить коэффициенты
1. CuO+H 2 → Cu+H 2 O
2. K 2 CO 3 +H 3 PO 4 →K 3 PO 4 +H 2 O+CO 2
3. H 2 O→H 2 +O 2
4. CaO + HCl→CaCl 2 +H 2 O
5. MgCl 2 +K 2 SO 4 →MgSO 4 +KCl
6. NaCl+AgNO 3 →NaNO 3 +AgCl
7. Ca(OH) 2 +H 3 PO 4 →Ca 3 PO 4 +H 2 O
8. Cu(NO 3 ) 2 +NaCl→CuCl 2 +NaNO 3
9. FeCl 3 +NaOH→Fe(OH) 3 +NaCl
10. Zn + 2HCl → ZnCl 2 + H 2









































