Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа №2
с. Федоровка МР Федоровский район
Республики Башкортостан
| РАССМОТРЕНА на заседании ШМО Протокол № ______ от «____» _________ 2020г. Руководитель ШМО __________/______________ | СОГЛАСОВАНО Заместитель директора по УВР _____________/ Т.В. Занина
«___» ___________ 2020г. | УТВЕРЖДАЮ И.о.директора МБОУ СОШ№2 ____________/И.Г.Дементьева Приказ № _________ от «___» ___________ 2020г.
|
РАБОЧАЯ ПРОГРАММА
по химии 10 класс
на 2020-2021 учебный год
Разработала: О.Д. Шишкина
учитель химии и биологии
МБОУ «СОШ №2 с.Федоровка»
2020
ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОСВОЕНИЯ УЧЕБНОГО ПРЕДМЕТА
Требования к результатам освоения основных образовательных программ структурируются по ключевым задачам общего образования, отражающим индивидуальные, общественные и государственные потребности, и включают личностные, метапредметные и предметные результаты.
Основные личностные результаты освоения курса химии:
формирование ответственного отношения к учению, готовности и способности учащихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию, осознанному выбору и построению дальнейшей индивидуальной траектории образования на базе ориентировки в мире профессий и профессиональных предпочтений, с учётом устойчивых познавательных интересов, а также на основе формирования уважительного отношения к труду, развития опыта участия в социально значимом труде;
формирование целостного мировоззрения, соответствующего современному уровню развития науки и общественной практики, учитывающего социальное, культурное, языковое, духовное многообразие современного мира;
формирование коммуникативной компетентности в общении и сотрудничестве со сверстниками, детьми старшего и младшего возраста, взрослыми в процессе образовательной, общественно полезной, учебно-исследовательской, творческой и других видов деятельности;
формирование ценности здорового и безопасного образа жизни; усвоение правил индивидуального и коллективного безопасного поведения в чрезвычайных ситуациях, угрожающих жизни и здоровью людей;
формирование основ экологической культуры, соответствующей современному уровню экологического мышления, развитие опыта экологически ориентированной рефлексивно-оценочной и практической деятельности в жизненных ситуациях.
Метапредметные результаты обучения в старшей школе состоят из освоенных учащимися межпредметных понятий и универсальных учебных действий (регулятивные, познавательные, коммуникативные), способности их использования в учебной, познавательной и социальной практике, самостоятельности планирования и осуществления учебной деятельности и организации учебного сотрудничества с педагогами и сверстниками, к проектированию и построению индивидуальной образовательной траектории.
Основные метапредметные результаты обучения химии:
умение самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учёбе познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности;
умение самостоятельно планировать пути достижения целей, в том числе альтернативные, осознанно выбирать наиболее эффективные способы решения учебных и познавательных задач;
умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий и требований, корректировать свои действия в соответствии с изменяющейся ситуацией;
умение оценивать правильность выполнения учебной задачи, собственные возможности её решения;
владение основами самоконтроля, самооценки, принятия решений и осуществления осознанного выбора в учебной и познавательной деятельности;
умение определять понятия, создавать обобщения, устанавливать аналогии, классифицировать, самостоятельно выбирать основания и критерии для классификации, устанавливать причинно-следственные связи, строить логическое рассуждние, умозаключение (индуктивное, дедуктивное и по аналогии) и делать выводы;
умение создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач;
умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками; работать индивидуально и в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учёта интересов; формулировать, аргументировать и отстаивать своё мнение;
умение осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих чувств, мыслей и потребностей; планирования и регуляции своей деятельности; владение устной и письменной речью, монологической контекстной речью;
формирование и развитие компетентности в области использования информационно-коммуникационных технологий;
формирование и развитие экологического мышления, умение применять его в познавательной, коммуникативной, социальной практике и профессиональной ориентации.
Планируемые предметные результаты освоения курса химии 11 класса
В результате изучения курса химии 11 класса учащиеся должны
Знать:
важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие,
основные законы и теории химии: сохранения массы веществ, постоянства состава, периодический закон;химической связи, электролитической диссоциации;
важнейшие вещества и материалы: металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения
Уметь
называть изученные вещества по "тривиальной" или международной номенклатуре;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам характеризовать: элементы малых периодов по их положению в периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов соединений;
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов:
выполнять химический эксперимент по распознаванию важнейших веществ;
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту и на производстве;
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
- приготовления растворов заданной концентрации в быту и на производстве;
- критической оценки достоверности химической информации, поступающей из разных источников.
Содержание программы учебного курса
Раздел 1. МЕТОДЫ НАУЧНОГО ПОЗНАНИЯ
Научные методы исследования химических веществ и превращений. Роль химического эксперимента в познании природы. Моделирование химических явлений. Взаимосвязь химии, физики, математики и биологии. Естественнонаучная картина мира.
Раздел 2. ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
Атом. Модели строения атома. Ядро и нуклоны. Нуклиды и изотопы. Электрон. Дуализм электрона. Квантовые числа. Атомная орбиталь. Распределение электронов по орбиталям. Электронная конфигурация атома. Валентные электроны. Основное и возбужденные состояния атомов.
Современная формулировка периодического закона и современное состояние периодической системы химических элементов Д.И.Менделеева. Электронные конфигурации атомов переходных элементов.
Молекулы и химическая связь. Ковалентная связь, ее разновидности и механизмы образования. Характеристики ковалентной связи. Комплексные соединения. Электроотрицательность. Степень окисления и валентность. Гибридизация атомных орбиталей. Пространственное строение молекул. Полярность молекул. Ионная связь. Металлическая связь. Водородная связь. Межмолекулярные взаимодействия. Единая природа химических связей.
Вещества молекулярного и немолекулярного строения. Современные представления о строении твердых, жидких и газообразных веществ.
Причины многообразия веществ: изомерия, гомология, аллотропия, изотопия.
Классификация и номенклатура неорганических и органических веществ.
Чистые вещества и смеси. Дисперсные системы. Коллоидные системы. Истинные растворы. Растворение как физико-химический процесс. Тепловые явления при растворении. Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная и моляльная концентрации.
Химические реакции, их классификация в неорганической и органической химии.
Закономерности протекания химических реакций. Тепловые эффекты реакций. Термохимические уравнения. Понятие об энтальпии и энтропии. Энергия Гиббса. Закон Гесса и следствия из него.
Скорость реакции, ее зависимость от различных факторов. Закон действующих масс. Элементарные и сложные реакции. Механизм реакции. Энергия активации. Катализ и катализаторы.
Обратимость реакций. Химическое равновесие. Константа равновесия. Смещение равновесия под действием различных факторов. Принцип Ле Шателье.
Электролитическая диссоциация. Сильные и слабые электролиты. Константа диссоциации. Реакции ионного обмена. Произведение растворимости. Кислотно-основные взаимодействия в растворах. Амфотерность. Ионное произведение воды. Водородный показатель (рН) раствора. Гидролиз органических и неорганических соединений.
Окислительно-восстановительные реакции. Методы электронного и электронно-ионного баланса. Ряд стандартных электродных потенциалов. Коррозия металлов и способы защиты от нее. Химические источники тока. Электролиз растворов и расплавов.
Раздел 3. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Характерные химические свойства металлов, неметаллов и основных классов неорганических соединений.
Водород. Изотопы водорода. Соединения водорода с металлами и неметаллами. Вода. Пероксид водорода.
Галогены. Галогеноводороды. Галогениды. Кислородсодержащие соединения хлора.
Кислород. Оксиды и пероксиды. Озон.
Сера. Сероводород и сульфиды. Оксиды серы. Сернистая и серная кислоты и их соли.
Азот. Аммиак, соли аммония. Оксиды азота. Азотистая и азотная кислоты и их соли.
Фосфор. Фосфин. Оксиды фосфора. Фосфорные кислоты. Ортофосфаты.
Углерод. Метан. Карбиды кальция, алюминия и железа. Угарный и углекислый газы. Угольная кислота и ее соли.
Кремний. Силан. Оксид кремния (IV). Кремниевые кислоты, силикаты.
Благородные газы.
Щелочные и щелочно-земельные металлы и их соединения.
Алюминий и его соединения.
Переходные элементы (медь, серебро, цинк, ртуть, хром, марганец, железо) и их соединения.
Комплексные соединения переходных элементов.
Общие способы получения металлов. Понятие о металлургии. Сплавы (черные и цветные).
Раздел 4. ЭКСПЕРИМЕНТАЛЬНЫЕ ОСНОВЫ ХИМИИ
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами.
Физические методы разделения смесей и очистки веществ. Кристаллизация, экстракция, дистилляция.
Синтез неорганических газообразных веществ.
Синтез твердых и жидких веществ. Качественный и количественный анализ веществ. Определение характера среды. Индикаторы. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений, обнаружение функциональных групп. Измерение физических свойств веществ (масса, объем, плотность). Современные физико-химические методы установления структуры веществ. Химические методы разделения смесей.
Раздел 5. ХИМИЯ И ЖИЗНЬ
Химические процессы в живых организмах. Биологически активные вещества. Химия и здоровье. Проблемы, связанные с применением лекарственных препаратов.
Химия в повседневной жизни. Моющие и чистящие средства. Правила безопасной работы со средствами бытовой химии.
Общие принципы химической технологии.
Химическое загрязнение окружающей среды и его последствия.
Проблемы безопасного использования веществ и химических реакций в современной жизни. Токсичные, горючие и взрывоопасные вещества.
Источники химической информации: учебные, научные и научно-популярные издания, компьютерные базы данных, ресурсы Интернета.
Календарно-тематический план
Тематическое планирование
| № п/п | Наименование раздела | Количество часов |
| 1 | Введение. Методы познания в химии | 1 |
| 2 | Повторение курса 10 класса | 5 |
| 3 | Основы теоретической химии» Строение атома | 9 |
| 4 | Строение вещества | 17 |
| 5 | Химические реакции | 23 |
| 6 | Вещества и их свойства | 34 |
| 7 | Химический практикум | 4 |
| 8 | Химия в жизни общества | 5 |
| 9 | Повторение пройденного | 4 |
|
| Итого | 102 |
| Предмет | Класс | Всего кол-во часов | Кол-во часов в неделю |
Количество |
| Контр. Работ | Зачетов | Тестовых заданий | практич работ | Лабор., работ | Демонстрация |
| химия | 11 | 102 | 3 | 6 | 4 | 10 |
6 | 3 |
|
Календарно-тематический план по химии 11 класс
| № п./п | Содержание (раздел, тема) | Календарные сроки |
| план | факт |
| Раздел. Методы познания в химии -1 час |
| 1 | Вводный инструктаж. Научные методы познания веществ и химических явлений. Роль эксперимента и теории в химии. | 1.09 |
|
| Повторение курса 10 класса - 5 часов |
| 2 | Строение органических веществ | 5.09 |
|
| 3 | Классификация органических соединений | 5.09 |
|
| 4 | Генетическая связь между классами органических соединений | 8.09 |
|
| 5 | Решение задач на вывод формул органических соединений | 12.09 |
|
| 6 | Входная контрольная работа | 12.09 |
|
| Раздел «Основы теоретической химии» Строение атома – 9 часов |
| 7 | Атом - сложная частица. Изотопы. | 15.09 |
|
| 8 | Электронные конфигурации атомов. Состояние электронов в атоме. Электронная классификация элементов(s-,р-элементы). | 19.09 |
|
| 9 | Состояние электронов в атоме. Особенности строения электронных оболочек атомов переходных элементов | 19.09 |
|
| 10 | Валентные возможности атомов | 22.09 |
|
| 11 | Периодический закон и периодическая система химических элементов в свете учения о строении атомов | 25.09 |
|
| 12 | Периодический закон и строение атомов | 25.09 |
|
| 13 | Обобщение и систематизация знаний по теме «Строение атома» | 29.09 |
|
| 14 | Контрольная работа №2 «Строение атома и периодический закон» | 2.10 |
|
| Раздел «Основы теоретической химии» Строение вещества – 17 часов |
| 15 | Ионная химическая связь | 2.10 |
|
| 16 | Ковалентная химическая связь. | 6.10 |
|
| 17 | Межмолекулярное взаимодействие | 9.10 |
|
| 18 | Типы кристаллических решеток | 9.10 |
|
| 19 | Типы кристаллических решеток | 13.10 |
|
| 20 | Свойства ковалентной химической связи | 16.10 |
|
| 21 | Гибридизация электронных орбиталей и геометрия молекул | 16.10 |
|
| 22 | Гибридизация электронных орбиталей и геометрия молекул | 20.10 |
|
| 23 | Теория химического строения органических соединений | 23.10 |
|
| 24 | Полимеры органические и неорганические | 23.10 |
|
| 25 | Полимеры органические и неорганические | 6.11 |
|
| 26 | Причины многообразия веществ: изомерия, гомология, аллотропия, изотопия. | 6.11 |
|
| 27 | Дисперсные системы и растворы | 10.11 |
|
| 28 | Истинные растворы. Способы выражения концентрации растворов: массовая доля растворённого вещества. | 13.11 |
|
| 29 | Решение задач на вывод формул органических и неорганических соединений | 13.11 |
|
| 30 | Обобщение и систематизация знаний по теме «Строение вещества» | 17.11 |
|
| 31 | Контрольная работа №3 «Строение вещества» | 20.11 |
|
| Химические реакции -23часа |
| 32 | Классификация химических реакций по различным критериям | 20.11 |
|
| 33 | Классификация химических реакций. Тепловой эффект химической реакции. | 24.11 |
|
| 34 | Решение задач на тепловой эффект химической реакции | 27.11 |
|
| 35 | Окислительно-восстановительные реакции. | 27.11 |
|
| 36 | Скорость химической реакции | 1.12 |
|
| 37 | Катализ. Гомогенный и гетерогенный катализ. | 4.12 |
|
| 38 | Химическое равновесие | 4.12 |
|
| 39 | Решение задач и упражнений по термохимии и смещению химического равновесия | 8.12 |
|
| 40 | Окислитель. Восстановитель. Окислительно-восстановительные реакции. | 11.12 |
|
| 41 | Окислительно-восстановительные реакции | 11.12 |
|
| 42 | Окислительно-восстановительные реакции в неорганической и органической химии. | 15.12 |
|
| 43 | Выполнение упражнений на окислительно-восстановительные реакции. | 18.12 |
|
| 44 | Электролитическая диссоциация | 18.12 |
|
| 45 | Реакции ионного обмена в водных растворах.
| 22.12 |
|
| 46 | Реакции ионного обмена. Л.О №1 Проведение реакций ионного обмена для характеристики свойств электролитов. | 25.12 |
|
| 47 | Среда водных растворов: кислая, нейтральная, щелочная. Водородный показатель (рН) раствора. | 25.12 |
|
| 48 | Гидролиз неорганических веществ. | 29.12 |
|
| 49 | Гидролиз органических веществ. | 15.01 |
|
| 50 | Гидролиз. Л.О №2 Определение характера среды раствора с помощью универсального индикатора. | 15.01 |
|
| 51 | Решение задач по химическим уравнениям. | 19.01 |
|
| 52 | Практическая работа №2 Решение экспериментальных задач по идентификации органических соединений | 22.01 |
|
| 53 | Обобщение и систематизация знаний по теме «Химические реакции» | 22.01 |
|
| 54 | Контрольная работа №4 «Химические реакции» | 26.01 |
|
| Раздел «Неорганическая химия» Вещества и их свойства -34часов |
| 55 | Классификация неорганических веществ | 29.01 |
|
| 56 | Классификация неорганических и органических веществ | 29.01 |
|
| 57 | Металлы. Электрохимический ряд напряжения металлов. Свойства металлов. | 2.02 |
|
| 58 | Коррозия металлов | 5.02 |
|
| 59 | Общие способы получения металлов | 5.02 |
|
| 60 | Электролиз расплавов. | 9.02 |
|
| 61 | Электролиз растворов. Выполнение упражнений. | 12.02 |
|
| 62 | Металлы главных подгрупп (I группа) | 12.02 |
|
| 63 | Металлы главных подгрупп (II группа) | 16.02 |
|
| 64 | Металлы главных подгрупп (Al) | 19.02 |
|
| 65 | Металлы побочных подгрупп (железо, хром) | 19.02 |
|
| 66 | Металлы побочных подгрупп (марганец) | 23.02 | Праздничный день |
| 67 | Металлы побочных подгрупп (медь, цинк, серебро) | 26.02 | Объединение тем |
| 68 | Решение задач и упражнений по теме: «металлы». | 26.02 |
|
| 69 | Неметаллы | 2.03 |
|
| 70 | Изменение кислотных свойств водородных соединений | 5.03 |
|
| 71 | Изменение кислотных свойств высших оксидов и гидроксидов неметаллов | 5.03 |
|
| 72 | Галогены | 9.03 |
|
| 73 | Халькогены | 12.03 |
|
| 74 | Подгруппа азота | 12.03 |
|
| 75 | Аммиак | 16.03 |
|
| 76 | Решение задач и упражнений по теме неметаллы | 19.03 |
|
| 77 | Кислоты | 19.03 |
|
| 78 | Особенности свойств серной кислоты | 23.03 |
|
| 79 | Особенности свойств азотной кислоты | 26.03 |
|
| 80 | Особенности свойств муравьиной кислоты | 26.03 |
|
| 81 | Основания неорганические и органические | 6.04 |
|
| 82 | Амфотерные соединения | 9.04 |
|
| 83 | Амфотерные соединения и их свойства | 9.04 |
|
| 84 | Генетическая связь между классами неорганических соединений | 13.04 |
|
| 85 | Генетическая связь между классами органических соединений | 16.04 |
|
| 86 | Практическая работа №3 Генетическая связь между классами неорганических соединений. | 16.04 |
|
| 87 | Обобщение и систематизация знаний по теме «Вещества и их свойства» | 20.04 23.04 |
|
| 88 | Контрольная работа №5 «Вещества и их свойства» | 23.04 |
|
| Раздел «Экспериментальные основы химии» Химический практикум – 4 часа |
| 89 | Работа над ошибками. Практическая работа №3 Получение газов и изучение их свойств | 27.04 |
|
| 90 | Практическая работа №4 Решение экспериментальных задач по неорганической химии | 30.04 |
|
| 91 | Практическая работа №5 Решение экспериментальных задач по органической химии | 30.04 |
|
| 92 | Практическая работа №6 Сравнение свойств неорганических и органических соединений | 4.05 |
|
| Раздел «Химия и жизнь» Химия в жизни общества-5 часов |
| 93 | Химия и производство. Серная кислота. | 7.05 |
|
| 94 | Промежуточная аттестация | 7.05 |
|
| 95 | Химия и производство | 11.05 |
|
| 96 | Химия и сельское хозяйство | 14.05 |
|
| 97 | Химия и проблемы окружающей среды | 14.05 |
|
| 98 | Химия и повседневная жизнь. Л.О №3 Знакомство образцами лекарственных веществ. | 18.05 |
|
| Итог-4 часа |
| 99 | Решение задач на массовую долю растворенного вещества и избыток и недостаток | 21.05 |
|
| 100 | Решение задач по химии. | 21.05 |
|
| 101 | Повторение обобщение курса общей химии. | 25.05 | Объединение тем |
| 102 | Итоговый урок по курсу «Общая химия» | 25.05 |
|
Всего- 101 Контрольных - 6 Практических - 6 Лабораторных- 3
График контрольных работ
| № п/п | Раздел | Тема | Даты проведения |
| план | факт |
| 1 | Основы теоретической химии | Входная контрольная работа | 11.09 |
|
| 2 | Основы теоретической химии | Строение атома и периодический закон | 02.10 |
|
| 3 | Основы теоретической химии | Строение вещества | 18.11 |
|
| 4 | Основы теоретической химии | Химические реакции | 23.01 |
|
| 5 | Основы теоретической химии | Вещества и их свойства | 23.04 |
|
| 6 | Основы теоретической химии | Промежуточная аттестация | 06.05 |
|
График практических работ
| № п/п | Раздел | Тема | Даты проведения |
| план | факт |
| 1 | Экспериментальные основы химии | Решение экспериментальных задач по идентификации химических соединений | 20.01 |
|
| 2 | Экспериментальные основы химии | Генетическая связь между классами неорганических соединений | 17.04 |
|
| 3 | Экспериментальные основы химии | Получение газов и изучение их свойств. | 24.04 |
|
| 4 | Экспериментальные основы химии | Решение экспериментальных задач по неорганической химии. | 28.04 |
|
| 5 | Экспериментальные основы химии | Решение экспериментальных задач по органической химии. | 30.04 |
|
| 6 | Экспериментальные основы химии | Сравнение свойств неорганических и органических соединений | 1.05 |
|
График лабораторных опытов
| № п/п | Раздел | Тема | Даты проведения |
| план | Факт |
| 1 | Экспериментальные основы химии | Реакции ионного обмена для характеристики свойств электролитов | 23.12 |
|
| 2 | Экспериментальные основы химии | Определение характера среды с помощью индикатора. | 15.01 |
|
| 3 | Экспериментальные основы химии | Знакомство образцами лекарственных веществ | 15.05 |
|
Входная контрольная работа(11 класс)
1 вариант
1. Определите степень окисления и валентность атомов в молекулах аммиака, перманганата калия, этилового спирта, метана
2. Напишите формулу гомолога для пропана.
3. Напишите возможные изомеры для пентана и дайте названия.
4. Назовите органические соединения и определите класс:
а) CH2 = CH- CH3
б) CH3-CH2-OH
в) CH3-CH2-Cl
г) CH2=CH-CH=CH2
д) HC≡C-CH3
е) CH3-COOC2H5
ж) CH3- CH2-COOH
5. Запишите формулу глюкозы, бутана, уксусной кислот.
6. Определите, к какому классу органических соединений относятся формулы:
1. Алканы а) R-COOR
2. Алкены б) CnH2n-2
3. Альдегиды в) R-COH
4. Алкины г) R-NH2
5. Спирты д) CnH2n+2
6. Алкадиены е) R-COOH
7. Карбоновые кислоты ж) CnH2n+1OH
8. Жиры з) H2N-CH(R)-COOH
9. Амины и) CnH2n-2
10. Аминокислоты к) CnH2n
7. Найти объем углекислого газа, полученного при разложении 200г карбоната кальция, содержащего 5%примесей.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Электроны были открыты:
А. Н. Бором. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Порядковый номер элемента в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом нейтронов в атоме.
(2 балла). Общий запас энергии электронов в атоме характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего энергетического уровня: А. B и Si. Б. S и Se. В. K и Ca. Г. Cr и Fe.
(2 балла). s – Элементом является: А. Барий. Б. Америций. В. Криптону. Г. Рутению.
(2 балла). Электронная конфигурация … 3d64s2 соответствует элементу: А. Аргону. Б. Железу. В. Криптону. Г. Рутению.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Be(OH)2. Б. Mg(OH)2. В. H2SiO3. Г. Ba(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Sr – Rb – K. Б. Be – Li – K. В. Na – K – Ca. Г. Al – Mg – Be.
(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. Э2О5.
(2 балла). Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают: А. 5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .
(9 баллов). Установите соответствие.
Элемент: I. Бериллий. II. Натрий. III. Хлор. IV. Азот.
Электронная формула: А. 1s22s2. Б. 1s22s22p3. В. 1s22s22p63 s1. Г. 1s22s22p63 s23p5.
Формула высшего оксида: 1. Э2О. 2. ЭО. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида: а. ЭОН. Б. Э(ОН)2. в. НЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: бериллий, бор, магний, натрий – в порядке возрастания восстановительных свойств. Объясните ответ.
(6 баллов). Как и почему в Периодической системе изменяются неметаллические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 31 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для оксида элемента 2-го периода, главной подгруппы I группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Атомные ядра были открыты:
А. Д. Менделеевым. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Номер периода в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом электронов в атоме.
(2 балла). Форму электронных орбиталей характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. S и Cl. Б. Be и B. В. Kr и Xe. Г. Mo и Se.
(2 балла). p – Элементом является: А. Скандий. Б. Барий. В. Мышьяк. Г. Гелий.
(2 балла). Электронная конфигурация … 3d104s2 соответствует элементу: А. Кальцию. Б. Криптону. В. Кадмию. Г. Цинку.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Zn(OH)2. Б. Mg(OH)2. В. Ca(OH)2. Г. Cr(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Mg – Ca – Zn. Б. Al – Mg – Ca. В. Sr – Rb – K. Г. Ge – Si – Sb.
(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104 s24p1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. Э2О5.
(2 балла). Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают: А. 4020Ca. Б. 4220Ca. В. 4420Ca. Г. 4820Ca.
(9 баллов). Установите соответствие.
Элемент: I. Алюминий. II. Калий. III. Селен. IV. Магний.
Электронная формула: А. 1s22s22p63s23p1. Б. 1s22s22p63s2. В. 1s22s22p63 s23p63d104 s24p4. Г. 1s22s22p63 s23p64 s1.
Формула высшего оксида: 1. Э2О. 2. Э2О3. 3. ЭО. 4. ЭО3.
Формула высшего гидроксида: а. ЭОН. Б. Э(ОН)2. в. Э(ОH)3. г. Н2ЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Объясните ответ.
(6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для высшего оксида элемента 3 -го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
| Контрольная работа по химии №2 11кл. Строение вещества 1 вариант. 1. Определите все возможные типы химической связи в молекуле Na2HPO3. Составьте электронную и структурную формулы вещества. 2. Расположите вещества по мере возрастания полярности связи: BeF2; CF4; LiF; ВF3. 3. Укажите тип гибридизации и геометрическую форму молекул: BeF2 и ОF2 4. Составьте структурные формулы для изомеров вещества состава С6Н10О. Назовите их. 5. Задача. Определите простейшую химическую формулу, если массовые доли элементов: водорода 4,17%, кремния 29,17%, остальное – кислород. Mr(вещества)=96.
|
Контрольная работа по химии №2 11кл. Строение вещества 2 вариант. 1. Определите все возможные типы химической связи в молекуле Na2S2O3. Составьте электронную и структурную формулы вещества. 2. Расположите вещества по мере возрастания полярности связи: H2O, CH4, HF, NH3. 3. Укажите тип гибридизации и геометрическую форму ионов: H3O+ и NH4+. 4. Составьте структурные формулы для изомеров вещества состава С7Н12О. Назовите их. 5. Задача. Определите простейшую химическую формулу, если массовые доли элементов: фосфора 38,75%, кислорода 60%, остальное – водород. Mr(вещества)=240.
|
Контрольная работа по теме: «Химические реакции» 11 класс
1 вариант
Задание 1. Составьте уравнения реакций, соответствующих схеме
сера→оксид серы (IV)→оксид серы (VI)→серная кислота→сульфат алюминия
Укажите типы реакций по признакам «число и состав реагентов и продуктов реакции» и «тепловой эффект реакции»
Задание 2. Составьте уравнение реакции по описанию
- при нагревании из нитрата серебра образуется серебро, оксид азота (IV) и кислород
Укажите тип реакции по признакам «число и состав реагентов и продуктов реакции» и «тепловой эффект реакции»
Задание 3. Составьте уравнение реакции по схеме:
Al + H2SO4 →
Укажите тип реакции по признакам «число и состав реагентов и продуктов реакции»
Задание 4. Допишите левую часть уравнения реакции по известной правой части:
_____________ + _____________ = Cu(OH) 2 + 2KNO3
Укажите тип реакции по признакам «число и состав реагентов и продуктов реакции»
Задание 5. Укажите, в какую сторону сместится равновесие в реакции при изменении следующих факторов
СO(г) + O2 (г) ↔CO2 (г) + Q
А)повышение концентрации реагентов
Б) повышение концентрации продуктов
В) повышение температуры
Г) понижение температуры
Д) повышение давления
Е) понижение давления
Задание 6. Выберите схемы, показывающие
А) процесс окисления:
1) S0 → S-2 2) S+4 → S +6 3) S0 → S+4 4) S+6 → S0
Б) процесс восстановления
1) N0 → N-3 2) N+2 → N+4 3) N+3 → N+5 4) N+5 → N0
Задание 7. Расставьте коэффициенты в уравнениях реакций методом электронного баланса. Укажите окислитель и восстановитель.
HNO3 + P + H2O →H3PO4 + NO2
Задание 8. Составьте уравнения реакций электролиза
1.расплава бромида кальция
2.раствора сульфата натрия на нерастворимом аноде
Задание 9. Запишите молекулярное и ионное уравнение гидролиза и укажите окраску лакмуса в растворе
- сульфат алюминия
Задание 10. Допишите молекулярное уравнение реакции и составьте полное и сокращенное ионное уравнение реакции:
Cr2(SO4)3 + NaOH →
Контрольная работа по теме: «Химические реакции» 11 класс
2 вариант
Задание 1. Составьте уравнения реакций, соответствующих схеме
фосфор→оксид фосфора (V)→ фосфорная кислота→фосфат натрия
Укажите типы реакций по признакам «число и состав реагентов и продуктов реакции» и «тепловой эффект реакции»
Задание 2.Составьте уравнение реакции по описанию
- при нагревании из азотной кислоты образуется оксид азота (IV), вода и кислород
Укажите тип реакции по признакам «число и состав реагентов и продуктов реакции» и «тепловой эффект реакции»
Задание 3.Составьте уравнение реакции по схеме:
Fe2O3 + Mg →
Укажите тип реакции по признакам «число и состав реагентов и продуктов реакции»
Задание 4. Допишите левую часть уравнения реакции по известной правой части:
_____________ + _____________ = Fe(OH) 3 + 3NaCl
Укажите тип реакции по признакам «число и состав реагентов и продуктов реакции»
Задание 5. Укажите, в какую сторону сместится равновесие в реакции при изменении следующих факторов
C2H4 (г) + H2 (г) ↔ C2H6 (г) + Q
А)повышение концентрации реагентов
Б) повышение концентрации продуктов
В) повышение температуры
Г) понижение температуры
Д) повышение давления
Е) понижение давления
Задание 6. Выберите схемы, показывающие
А) процесс окисления:
1) S0 → S-2 2) S+4 → S +6 3) S0 → S+4 4) S+6 → S0
Б) процесс восстановления
1) N0 → N-3 2) N+2 → N+4 3) N+3 → N+5 4) N+5 → N0
Задание 7.Расставьте коэффициенты в уравнениях реакций методом электронного баланса. Укажите окислитель и восстановитель.
HCl + KMnO4 →Cl2 + KCl + MnCl2 + H2O
Задание 8. Составьте уравнения реакций электролиза
1.расплава йодида калия
2.раствора хлорида меди на нерастворимом аноде
Задание 9. Запишите молекулярное и ионное уравнение гидролиза и укажите окраску лакмуса в растворе
- хлорид железа (II)
Задание 10. Допишите молекулярное уравнение реакции и составьте полное и сокращенное ионное уравнение реакции:
AlCl3 + H3PO4 →
Контрольная работа №4
Вещества и их свойства
Вариант 1.
Часть 1.
Выберите правильный ответ:
1) Ряд веществ относится к группе основных оксидов:
А. CaO, Na2O, CuO, Б. AI2 O3, SO2, BaO, В. CO2, FeO, CrO Г. SO3, MgO, BeO.
2)Оксиду серы (IV) соответствует кислота:
А. серная, Б. сернистая, В. сероводородная, Г. угольная.
3) Сульфат бария образуется при взаимодействии:
А. серной кислоты с хлоридом бария, Б. серной кислоты с хлоридом магния,
В. хлорида бария с оксидом серы (VI) , Г. сульфата натрия с карбонатом бария.
4)С уксусной кислотой взаимодействует каждое из двух предложенных веществ:
А. NaOH и CO2, Б. NaOH и Na2CO3, В. C2H4 и C2H5OH, Г. CO и C2H5OH.
5)С каждым веществом: водой, бромоводородом, водородом, может реагировать:
А. пропан, Б. этан, В. метанол, Г. бутен-1.
6)Гидроксид натрия может реагировать с группой веществ:
А. оксид алюминия и оксид серы (VI), Б.соляная кислота и оксид кальция,
В.сульфат меди (II) и сульфат бария, Г. гидроксид калия и хлорид натрия.
7) Взаимодействие оксида серы (IV) с водой относится к реакциям:
А. соединения, экзотермическим, Б. соединения, эндотермическим,
В. разложения, экзотермическим, Г. замещения, эндотермическим.
8) При термическом разложении гидроксида алюминия образуется:
А. алюминий и вода, Б. оксид алюминия и вода,
В. оксид алюминия и водород, Г. алюминий и водород.
9) При взаимодействии натрия с водой образуется:
А. оксид натрия и водород, Б. гидроксид натрия и водород,
В. пероксид натрия и водород, Г. гидроксид натрия.
10) При реакции какой кислоты с металлом не образуется водород:
А. Уксусная и соляная, Б. Азотная и концентрированная серная,
В. муравьиная и ортофосфорная, Г. угольная и серная.
Часть 2.
1. Составьте уравнение реакции подтверждающие общие свойства уксусной кислоты с минеральными кислотами.
2.Осуществите схему превращений с помощью уравнений реакций:
Fe → Fe CI3 → CI2→ СН3CI → С2Н6 →СО →CH3OH→НС=О
\
О
Часть 3.
1. Какова масса полученного осадка при взаимодействии 80г 20% раствора гидроксида натрия с 80г сульфата меди (II)?
11 класс
Контрольная работа №4
Вещества и их свойства
Вариант 2.
Часть 1.
Выберите правильный ответ:
1) Ряд веществ относится к группе кислотных оксидов:
А. CaO, Na2O, CuO, Б. AI2 O3, SO2, BaO, В. CO2, P2O5, SO3, Г. SO3, MgO, BeO.
2)Веществу Fe2O3 соответствует основание:
А. гидроксид железа (II), Б. гидроксид железа (III),
В. гидроксид хрома (III), Г. оксид железа (II),
3) Ацетат натрия образуется при взаимодействии:
А. уксусной кислоты с натрием, Б. серной кислоты с натрием,
В. натрия с оксидом серы (VI) , Г. сульфата натрия с карбонатом бария.
4)С аминоуксусной кислотой взаимодействует каждое из двух предложенных веществ:
А. NaOH и НCl, Б. NaOH и CO2, В. C2H4 и C2H5OH, Г. CO и C2H5OH.
5)С каждым веществом: водой, бромоводородом, водородом, может реагировать:
А. пропан, Б. этен, В. метанол, Г. бутан.
6)Гидроксид натрия может реагировать с группой веществ:
А. оксид калия и оксид серы (VI), Б.соляная кислота и хлорид железа (III),
В.сульфат меди (II) и сульфат бария, Г. гидроксид калия и хлорид натрия.
7) Взаимодействие натрия с водой относится к реакциям:
А. соединения, экзотермическим, Б. соединения, эндотермическим,
В. разложения, экзотермическим, Г. замещения, экзотермическим.
8. Какой объём (н.у.) кислорода потребуется для сжигания 10л метана:
А. 10л, Б. 20л, В. 5л, Г. 40л.
9. При взаимодействии оксида серы (VI) с водой образуется кислота:
А. серная, Б. фосфорная, В. сернистая, Г. сероводородная.
10. При взаимодействии нитрата серебра с какими кислотами образуется нерастворимый в кислотах осадок:
А. соляная и бромоводородная, Б. угольная с сернистая,
В. соляная и угольная, Г. муравьиная и уксусная.
Часть 2.
1. Составьте уравнения реакций, раскрывающие свойства гидроксида натрия.
2.Осуществите схему превращений с помощью уравнений реакций:
AI →AI(OH)3 → AI2O3→ СО2 →СО →СН3ОН→ СН3СООСН3→ СН3СООН →СН3СООNa
Часть 3.
1. Какова масса осадка, полученного при взаимодействии 152г 10% раствора сульфата железа ((II) с 10г гидроксида натрия?
Оценочные материалы
для проведения промежуточной аттестации по курсу химии 11 класса
(УМК Габриеляна – базовый уровень)
Проверяемые элементы содержания.
Часть 1 содержит задания с кратким ответом (1- 8 базовый уровень сложности и 9-12 повышенный уровень сложности).
1 – Строение атомов химических элементов Периодической системы Д. И. Менделеева
2 – Типы химической связи
3 – Типы кристаллических решеток
4 – Классификация неорганических соединений
5 – Скорость химических реакций
6 – Способы смещения химического равновесия
7 – Расчет массовой доли растворенного вещества в растворе
8 - Расчет по термохимическому уравнению
9 – Классификация органических соединений
10 – Химические свойства простых и сложных неорганических веществ
11 – Гидролиз солей
12 – Электролиз растворов солей
Часть 2 содержит три задания с развернутым ответом (высокий уровень сложности).
13 – Окислительно - восстановительные реакции, составление уравнивания методом электронного баланса.
14 – Решение задачи на вывод молекулярной формулы органического вещества.
Оценивание работы.
За правильный ответ в 1 части задания 1-8 – 1 балл
За полный правильный ответ в 1 части задания 9 - 12 – 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
За полный правильный ответ 2 части:
13 – 3 балла
14 – 3 балла
Итого максимально 22 балла.
Критерии оценивания 13 задания:
Определены степени окисления и составлен баланс – 1 балл;
Выставлены коэффициенты в исходное уравнение – 1 балл;
Определены окислитель и восстановитель – 1 балл (всего 3 балла)
Критерии оценивания 14 задания:
по 1 баллу за каждое правильно выполненное действие (всего 3 балла)
Шкала пересчета первичных баллов в отметку
| Общий балл | 0 - 6 | 7 - 13 | 14- 18 | 19 -22 |
| Отметка | 2 | 3 | 4 | 5 |
Ответы
| В | Часть 1 | Часть 2 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 1 | 3 | 3 | 2 | 2 | 2 | 1 | 2 | 4 | 2356 | 2361 | 2241 | 1344 | 2Cl2 + 2H2O + C→ 4HCl + CO2 | С4Н8 |
| 2 | 3 | 2 | 4 | 4 | 4 | 2 | 1 | 4 | 3213 | 1526 | 2143 | 1225 | 3S + 2KClO3 → 2KCl + 3SO2 | С7Н12 |
| 3 | 4 | 1 | 2 | 2 | 3 | 2 | 1 | 2 | 6123 | 2564 | 2432 | 2245 | 3H2S + 2KMnO4 →3S + 2MnO2 + 2H2O +2KOH | С3Н6 |
| 4 | 1 | 4 | 3 | 4 | 1 | 3 | 1 | 3 | 1232 | 3426 | 4214 | 4434 | 6HСl + 2HNO3→ 3Cl2 + 2NO + 4H2O | С7Н12 |
Итоговое тестирование по химии (11 класс)
Вариант 1
Часть 1 (выберите один верный ответ из четырех предложенных)
1. В атоме химического элемента, расположенного в 3 периоде, VI группе, главной подгруппе, заряд ядра равен 1) +3 2) +6 3) +16, 4) +18
2. Ионная связь характерна для 1) S8 2) SO3 3) K2S 4)H2S.
3. Кристаллическая решетка хлорида натрия 1) атомная 2) ионная 3) молекулярная 4) металлическая
4. Вещества, формулы которых СаO и СаCl2 являются соответственно
1) основным оксидом и основанием 3) амфотерным оксидом и кислотой
2) основным оксидом и солью 4) кислотой и основанием
5 Скорость реакции цинка с соляной кислотой не зависит от
1) концентрации кислоты 3) степени измельчения цинка
2) давления 4) температуры
6.Химическое равновесие в системе 2СO(газ) + О2(газ) ↔ 2СO2 (газ) + Q смещается вправо в результате
1) увеличения концентрации О2 3) повышения температуры
2) понижения давления 4) применения катализатора
7. Масса уксусной кислоты, содержащаяся в 0,5 л раствора её с массовой долей 80% (плотность 1,1 г/мл), равна 1) 480 г 2) 440 г 3) 160 г 4) 220 г
8. В соответствии с термохимическим уравнением 2Mg + SiO2 = 2MgO + Si + 372кДж, при получении 200 г оксида магния количество выделившейся теплоты будет равно
1) 1860 кДж 2) 465 кДж 3) 620 кДж 4) 930 кДж
9.Установить соответствие между молекулярной формулой вещества и классом органических соединений, к которому оно относится
Название вещества Класс
А) метаналь 1) арены
Б) глицерин 2) альдегиды
В) глицин 3) спирты
Г) пропин 4) алкены
5) аминокислоты
6) алкины
10.Установите соответствие между исходными веществами и продуктами их взаимодействия РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Na + H2O 1) Fe(OH)2+ NaCl
1) Fe(OH)2+ NaCl
Б) Na2O + H2O 2) NaOH + H2
2) NaOH + H2
В) NaOH+ SO3 3) NaOH
3) NaOH
Г) NaOH + FeCl2 4) Fe(OH)3+ NaCl
4) Fe(OH)3+ NaCl
5) Na2SO3 + H2O
6) Na2SO4 + H2O
11. Установите соответствие между названием соли и её отношением к гидролизу
НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) сульфид калия 1) гидролизуется по катиону
Б) сульфит натрия 2) гидролизуется по аниону
В) сульфат цезия 3) гидролизуется по катиону и аниону
Г) сульфат алюминия 4) не гидролизуется
12. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Na2S 1) cера
Б) BaCl2 2) сернистый газ
В) Pb(NO3)2 3) хлор
Г) CuSO4 4) кислород
5) азот
Часть 2 (дайте развернутый ответ)
13. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой Cl2 + H2O + C→ HCl + CO2. Определите окислитель и восстановитель.
14. Установите молекулярную формулу углеводорода, в котором содержится 14,29 % водорода, а его относительная плотность по азоту равна 2.
Итоговое тестирование по химии (11 класс)
Вариант 2
Часть 1 (выберите один верный ответ из четырех предложенных)
1. В атоме химического элемента, расположенного во 2 периоде, V группе, главной подгруппе, число электронов на внешнем уровне равно 1) 3 2) 5 3) 7 4)14
2. Ковалентную полярную связь имеет 1) О2 2) SO3 3)Сu 4)К2S
3. Металлическая кристаллическая решетка у 1) оксида цинка 2) воды 3) кислорода 4) магния
4. Вещества, формулы которых CO2 и Fe(OH)3, являются соответственно
1) основным оксидом и основанием 3) амфотерным оксидом и основанием,
2) амфотерным оксидом и солью 4) кислотным оксидом и амфотерным гидроксидом
5. Увеличению скорости реакции Fe(тв.) + S (тв.)= FeS(тв.) способствует
1) повышение давления 3) понижение температуры
2) понижение давления 4) измельчение и перемешивание Fe и S
6. В какой системе повышение давления смещает равновесие влево?
1) N2(газ) + 3Н2(газ) ↔ 2 NН3(газ) + Q 3) СO2(газ) + H2(газ) ↔ СO (газ) + H2O(газ) - Q
2) N2О4(газ) ↔ 2 NО2(газ) – Q 4) 4НСl(газ) + О2(газ) ↔ 2Cl2(газ) + H2O(газ) + Q
7. При растворении в 270 г воды сульфата калия был получен раствор с массовой долей соли 10%. Масса растворенного K2SО4 равна 1) 30 г 2) 60 г 3) 45г 4) 50г
8. В реакции, термохимическое уравнение которой 2AgNO3 = 2Ag + 2NO2 + O2 – 317 кДж, количество теплоты, необходимое для получения 10,8г серебра, равно
1) 31,7 кДж 2) 158,5 кДж 3) 5,3 кДж 4) 15,85 кДж
9. Установить соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит
Название соединения Общая формула
А) пропин 1) СnH2n+2
Б) циклогексан 2) СnH2n
В) пентан 3) СnH2n-2
Г) бутадиен 4) СnH2n-4
5) СnH2n-6
10. Установите соответствие между исходными веществами и продуктами их взаимодействия РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Al + НСl 1) AlСl3 + H2↑
1) AlСl3 + H2↑
Б) Al2O3 + NaOH→ t 2) Al(NO3)3 + H2O
В) Al(OH)3+ HNO3 3) Al(NO3)3
3) Al(NO3)3
Г) Al2(SO4)3 + KOH 4) NaAlO2 + H2↑
4) NaAlO2 + H2↑
5) NaAlO2 + H2O
6) Al(OH)3↓ + K2SO4
11. Установите соответствие между названием соли и её отношением к гидролизу
НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) карбонат натрия 1) гидролизуется по катиону
Б) хлорид аммония 2) гидролизуется по аниону
В) сульфат калия 3) гидролизуется по катиону и аниону
Г) сульфид алюминия 4) не гидролизуется
12. Установите соответствие между формулой соли и продуктом, образующимся на инертном катоде при электролизе её водного раствора
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) NiSO4 1) Ni и H2
Б) NaClO4 2) H2
В) LiCl 3) Nа
Г) AgNO3 4) Li
5) Ag
Часть 2 (дайте развернутый ответ)
13. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
S + KClO3 → KCl + SO2. Определите окислитель и восстановитель.
14. Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить молекулярную формулу вещества.
Итоговое тестирование по химии (11 класс)
Вариант 3
Часть 1 (выберите один верный ответ из четырех предложенных)
1. В атоме химического элемента, ядро которого содержит 12 протонов, число электронов на внешнем уровне равно 1) 4 2) 6 3) 8 4) 2
2. Химическая связь в РСl31) ковалентная полярная 2) металлическая 3) ковалентная неполярная 4)ионная
3. Ионную кристаллическую решетку имеет 1) хлор 2) хлорид натрия 3) хлорид фосфора (III) 4) натрий
4. Вещества, формулы которых HCl и AlCl3, являются соответственно
1) кислотой и основанием 3) амфотерным оксидом и кислотой
2) кислотой и солью 4) кислотой и амфотерным гидроксидом
5. С наибольшей скоростью при комнатной температуре происходит соляной кислоты и
1) свинца 2) цинка 3) магния 4)железа
6. В системе SO2(газ) + Cl2(газ) ↔ SO2Cl2 (газ) + Q химическое равновесие смещается вправо при
1) увеличении температуры 3) уменьшения давления
2) увеличения концентрации хлора 4) уменьшения концентрации SO2
7. Вычислите массу воды, которую надо добавить к 25 г 15%-ного раствора сульфата меди для получения 10% -ного раствора 1) 12,5 г 2) 125 г 3) 15,2 г 4) 10,2 г
8. В ходе реакции С + О2 = СО2 + 402 кДж выделилось 1206 кДж тепла. Масса угля, сгоревшего при этом равна: 1) 72 г 2) 36 г 3) 7,2 г 4) 108 г
9. Установить соответствие между молекулярной формулой вещества и классом органических соединений, к которому оно относится
Молекулярная формула Класс
А) С6Н5– COОH 1) cложные эфиры
Б) НСООСН3 2) простые эфиры
В) С2Н5–O–CH3 3) фенолы
Г) С6Н5–OH 4) спирты
5) альдегиды
6) карбоновые кислоты
10. Установите соответствие между исходными веществами и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Ca(OH)2 1) CaO + H2
1) CaO + H2
Б) Ca(OH)2 + H2S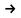 2) CaO + H2O
2) CaO + H2O
В) Ca(OH)2 + H2SO4 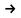 3) CaSO3 + H2O
3) CaSO3 + H2O
Г) Ca(OH)2 + SO3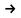 4) CaSO4 + H2O
4) CaSO4 + H2O
5) CaS+ 2H2O
6) CaSO4 + 2H2O
11.Установите соответствие между названием соли и её отношением к гидролизу
НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) карбонат калия 1) гидролизуется по катиону
Б) йодид кальция 2) гидролизуется по аниону
В) сульфид аммония 3) гидролизуется по катиону и аниону
Г) фосфат натрия 4) не гидролизуется
12. Установите соответствие между формулой соли и продуктом, образующимся на инертном катоде при электролизе её водного раствора
ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ
А) K2SO4 1) K
Б) ВаCl2 2) H2
В) Fe(NO3)3 3) Ba
Г) CuCl2 4) Fe и H2
5) Cu
6) Fe
Часть 2 (дайте развернутый ответ)
13. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой H2S + KMnO4 →S + MnO2 + H2O +KOH. Определите окислитель и восстановитель.
14. Определите формулу углеводорода, массовая доля водорода в котором составляет 14,3 %. Относительная плотность этого вещества по водороду равна 21.
Итоговое тестирование по химии (11 класс)
Вариант 4
Часть 1 (выберите один верный ответ из четырех предложенных)
1. Распределение электронов по уровням: 2, 8, 6 – соответствует атому 1)S 2)Si 3)O 4)Se
2. Ковалентную полярную связь имеет 1) Р4 2) СаO 3)K2О 4)H2О
3. Вещества с атомной кристаллической решеткой
1) О2 и Si 3) Si и SiО2
2) H2О и SiО2 4) О2 и H2О
4. Вещества, формулы которых O3 и H3PO4 являются соответственно
1) основным оксидом и основанием 3) амфотерным оксидом и кислотой
2) кислотным оксидом и кислотой 4) простым веществом и кислотой
5. Скорость реакции P4(тв) + 5O2(г) → P4O10(тв) не зависит от
1) количества взятого фосфора 3) температуры
2) степени измельчения P4 4) объёма взятого O2
6. Химическое равновесие в системе СаСО 3(тв.) ↔ СаО(тв.) + СO2 (газ) - Q смещается вправо в результате 1) увеличения концентрации СО2 3) повышения температуры
2) повышения давления 4) применения катализатора
7. К 1150 г 10%-ного раствора сульфата натрия добавили 115 г воды. Массовая доля сульфата натрия в полученном растворе равна 1) 9% 2) 8% 3) 7% 4) 6%
8. В результате реакции, термохимическое уравнение которой 2Cl2O7 = 2Cl2 + 7O2 + 574кДж выделилось 114,8 кДж теплоты. Объём получившегося при этом кислорода (при н.у.) составил:
1) 200 л 2) 4,48 л 3) 31,36 л 4) 8,96 л
9. Установить соответствие между молекулярной формулой вещества и классом органических соединений, к которому оно относится
Формула углеводорода Общая формула
А) СН3–СН2–CH2– CH(CH3)2 1) СnH2n+2
Б) CH3–C≡С–CH2–CH3 2) СnH2n-2
В) С6Н5– CH3 3) СnH2n-6
Г) СН2=СН– C(CH3)2 = СН2 4) СnH2n
5) СnH2n-4
10. Установите соответствие между исходными веществами и продуктами их взаимодействия РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe2O3 + SO3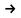 1) Fe SO4
1) Fe SO4
Б) Fe2O3 + H2SO4 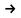 2) Fe(NO3)3 + H2O
2) Fe(NO3)3 + H2O
В) Fe2O3 + HNO3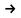 3) Fe2(SO4)3
3) Fe2(SO4)3
Г) Fe2O3 + N2O5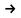 4) Fe2(SO4)3 + H2O
4) Fe2(SO4)3 + H2O
5) Fe(NO3)2 + H2O
6) Fe(NO3)3
11. Установите соответствие между названием соли и её отношением к гидролизу
НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) хлорид кальция 1) гидролизуется по катиону
Б) сульфит калия 2) гидролизуется по аниону
В) хлорид хрома (III) 3) гидролизуется по катиону и аниону
Г) нитрат бария 4) не гидролизуется
12. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора
А) Zn(NO3)2 1) cера
Б) LiF 2) фтор
В) FeCl2 3) хлор
Г) CuSO4 4) кислород
5) оксид азота (IV)
Часть 2 (дайте развернутый ответ)
13. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой HСl + HNO3→ Cl2 + NO + H2O. Определите окислитель и восстановитель.
14.Относительная плотность паров углеводорода по воздуху равна 3,31, а массовая доля водорода в нём равна 12,5 %. Определите молекулярную формулу углеводорода.
Методические материалы
для проведения промежуточной аттестации по курсу химии 11 класса
(УМК Габриеляна – базовый уровень)
Проверяемые элементы содержания.
Часть 1 содержит задания с кратким ответом (1- 8 базовый уровень сложности и 9-12 повышенный уровень сложности).
1 – Строение атомов химических элементов Периодической системы Д. И. Менделеева
2 – Типы химической связи
3 – Типы кристаллических решеток
4 – Классификация неорганических соединений
5 – Скорость химических реакций
6 – Способы смещения химического равновесия
7 – Расчет массовой доли растворенного вещества в растворе
8 - Расчет по термохимическому уравнению
9 – Классификация органических соединений
10 – Химические свойства простых и сложных неорганических веществ
11 – Гидролиз солей
12 – Электролиз растворов солей
Часть 2 содержит три задания с развернутым ответом (высокий уровень сложности).
13 – Окислительно - восстановительные реакции, составление уравнивания методом электронного баланса.
14 – Решение задачи на вывод молекулярной формулы органического вещества.
Оценивание работы.
За правильный ответ в 1 части задания 1-8 – 1 балл
За полный правильный ответ в 1 части задания 9 - 12 – 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
За полный правильный ответ 2 части:
13 – 3 балла
14 – 3 балла
Итого максимально 22 балла.
Критерии оценивания 13 задания:
Определены степени окисления и составлен баланс – 1 балл;
Выставлены коэффициенты в исходное уравнение – 1 балл;
Определены окислитель и восстановитель – 1 балл (всего 3 балла)
Критерии оценивания 14 задания:
по 1 баллу за каждое правильно выполненное действие (всего 3 балла)
Для подготовки обучающихся к проведению итоговой проверочной работы (в форме тестирования) подготовлен демонстрационный вариант.
Ответы
| В | Часть 1 | Часть 2 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| Д | 3 | 4 | 2 | 1 | 1 | 1 | 1 | 4 | 6125 | 4526 | 2341 | 1344 | 6HСl + 2HNO3→3Cl2 +2NO + 4H2O | С7Н12 |
Шкала пересчета первичных баллов в отметку
| Общий балл | 0 - 6 | 7 - 13 | 14- 18 | 19 -22 |
| Отметка | 2 | 3 | 4 | 5 |
Итоговое тестирование по химии (11 класс)
Демонстрационный вариант
Часть 1 (выберите один верный ответ из четырех предложенных)
1. В атоме химического элемента, расположенного в 3 периоде, V группе, главной подгруппе, заряд ядра равен 1) +3 2) +5 3) +15 4) +17
2. Ионная связь характерна для 1) S8 2) H2S 3) SO3 4)K2S
3. Кристаллическая решетка хлорида бария 1) атомная 2) ионная 3) молекулярная 4) металлическая
4. Вещества, формулы которых СаO и Са(ОН)2 являются соответственно
1) основным оксидом и основанием 3) амфотерным оксидом и кислотой
2) основным оксидом и солью 4) кислотой и основанием
5. Скорость реакции 4P (тв) + 5O2(г) → 2P2O5(тв) не зависит от
1) количества взятого фосфора 3) температуры
2) степени измельчения P 4) объёма взятого O2
6. Химическое равновесие в системе СаСО 3(тв.) ↔ СаО(тв.) + СO2 (газ) - Q смещается влево в результате 1) увеличения концентрации СО2 3) повышения температуры
2) понижения давления 4) применения катализатора
7. К 150 г 10%-ного раствора сульфата натрия добавили 15 г воды. Массовая доля сульфата натрия в полученном растворе равна 1) 9% 2) 8% 3) 7% 4) 6%
8. В результате реакции, термохимическое уравнение которой 2Cl2O7 = 2Cl2 + 7O2 + 574кДж выделилось 114,8 кДж теплоты. Объём получившегося при этом хлора (при н.у.) составил:
1) 200 л 2) 4,48 л 3) 31,36 л 4) 8,96 л
9. Установить соответствие между молекулярной формулой вещества и классом органических соединений, к которому оно относится
Молекулярная формула Класс
А) СН3– COОH 1) cложные эфиры
Б) СН3СООСН3 2) простые эфиры
В) СН3–O–CH3 3) фенолы
Г) С6Н5–СOH 4) спирты
5) альдегиды
6) карбоновые кислоты
10. Установите соответствие между исходными веществами и продуктами их взаимодействия РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Al + NaOH → t 1) NaAlO2
Б) Al2O3 + NaOH→ t 2) Al(NO3)3 + H2O
В) Al(OH)3+ HNO3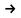 3) Al(NO3)3
3) Al(NO3)3
Г) Al2(SO4)3 + KOH 4) NaAlO2 + H2↑
4) NaAlO2 + H2↑
5) NaAlO2 + H2O
6) Al(OH)3↓ + K2SO4
11. Установите соответствие между названием соли и её отношением к гидролизу
НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) карбонат лития 1) гидролизуется по катиону
Б) ацетат аммония 2) гидролизуется по аниону
В) сульфат натрия 3) гидролизуется по катиону и аниону
Г) хлорид алюминия 4) не гидролизуется
12. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) K2S 1) cера
Б) СaCl2 2) сернистый газ
В) Ni(NO3)2 3) хлор
Г) CuSO4 4) кислород
5) азот
Часть 2 (дайте развернутый ответ)
13. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой HСl + HNO3→Cl2 + NO + H2O. Определите окислитель и восстановитель.
14. Установите молекулярную формулу углеводорода, в котором содержится 14,29 % водорода, а его относительная плотность по воздуху равна






 1) Fe(OH)2+ NaCl
1) Fe(OH)2+ NaCl

















