МБОУ «Свободинская средняя общеобразовательная школа»
Золотухинского района Курской области
«Угольная кислота и её соли»

Подготовила урок: учитель химии
Епишева Елена Владимировна
2019-2020 учебный год
Учитель: Епишева Елена Владимировна Класс 9А Урок химии по теме "Угольная кислота и её соли" Цель: усвоение новых знаний о свойствах угольной кислоты и её солей и их применении.
Задачи.
Изучить общие и специфические свойства угольной кислоты и её солей.
Рассмотреть характеристики и особенности угольной кислот, её солей и их применения.
Совершенствовать навыки составления уравнений реакций.
Создать условия для:
Повышения познавательной активности учащихся;
Развития умения работать в коллективе;
Воспитания общей культуры;
Воспитания ответственности и аккуратности, коммуникативных навыков, уважения к товарищам;
Воспитания позитивного отношения к химии;
Создать условия для развития УУД:
1) Познавательных:
Осознанное и произвольное построение речевого высказывания.
Смысловое чтение, определение основной и второстепенной информации.
Выбор наиболее эффективных способов решения задач.
Рефлексивные УУД.
Структурирование знаний.
Написание уравнений реакций (знаково-символическое).
Анализ объектов с целью выделения признаков.
Установление причинно-следственных связей.
Умение анализировать, строить план исследования, наблюдать и делать выводы на основе эксперимента, делать дедуктивные и индуктивные умозаключения.
Использование опыта как источника знаний; умение проводить и описывать эксперимент, наблюдать и делать выводы на химическом языке.
Выдвижение гипотез, их обоснование.
2) Личностных: самостоятельное создание способов решения проблем поискового характера.
3) Коммуникативных:
Постановка вопросов,
Умение точно выразить свои мысли,
Владение диалогической речи,
Сотрудничество в группе.
4) Регулятивных:
Целеполагание.
Планирование.
Контроль в форме сличения результата действия с заданным эталоном с целью обнаружения отклонений и отличий от эталона.
Оценка.
Саморегуляция.
Тип урока: Урок изучения нового материала.
Критерии достижения цели урока:
ученик должен ЗНАТЬ:
1) Химические свойства угольной кислоты и её солей.
2) Качественную реакцию на карбонат-ион.
3) Природные соединения угольной кислоты.
4) Названия солей угольной кислоты и их практическое применение.
ученик должен УМЕТЬ:
1) Давать характеристику угольной кислоте и её солей.
2) Записывать формулы кислых и средних солей и их называть.
3) Записывать уравнения реакций, подтверждающие основные химические свойства солей в молекулярном и ионном виде.
4) Практически определять наличие анионов СО3 2-и НСО3 - в растворе.
5) Объяснять взаимопревращения карбонатов и гидрокарбонатов в природе.
Методы обучения: активные методы обучения: эвристическая беседа, работа в группах – лабораторная работа в исследовательском варианте.
Применяемые технологии: технология развития критического мышления, технология проблемного обучения, кейс-технология.
Организационные формы:
фронтальная
индивидуальная
групповая
Оборудование:
наборы реактивов для проведения опытов,
компьютерная презентация,
Ход урока
(Урок сопровождается компьютерной презентацией учителя, составленной с помощью программы Power Point)
Организационный момент.
Приветствие: Добрый день, ребята. Я рада приветствовать вас на очередном уроке химии. Перед началом урока я пожелаю вам хорошего настроения и творческих успехов, надеюсь, что наш сегодняшний урок пройдёт плодотворно.
Актуализация знаний.
Учитель: Эпиграфом к уроку я взяла слова: «…У школьного мела, у стен дворца и у стен пирамиды один источник, одна основа…»
Как вы понимаете это высказывание? (Если нет ответа отметить, что вернемся к этому вопросу в конце урока).
Учитель: посмотрите на доску и скажите: «Что объединяет все эти изображения? (Углерод).
Стадия " вызов»
(мотивация, актуализация знаний, целеполагание).
Учитель:
1. Давайте составим с вами кластер: «Соединения углерода». Возьмите цветные ручки. Какие соединения образует углерод?

Какие соединения углерода мы уже изучили?
(Ответ: оксиды углерода)
Задание 1. Я предлагаю вам выполнить проверочную работу по этой теме. Для этого возьмите пульты и выберите правильный ответ на каждый приведенный вопрос.
Задание 2. Отложите пульты в сторону, и выполните тест. Для этого возьмите листы зеленого цвета у вас на столах и из предложенных утверждений
выберите те, которые справедливы:
I вариант: – для угарного газа (CO)
II вариант: – для углекислого газа (CO2)
Бесцветный газ, без запаха.
Газообразный при обычных условиях.
Ядовит.
Не ядовит.
Хорошо растворим в воде.
Плохо растворим в воде.
Газ легче воздуха.
Газ тяжелее воздуха.
Проявляет кислотные свойства.
В молекуле 3-я связь образуется по донорно-акцепторному механизму.
Соединяется с гемоглобином крови.
Степень окисления углерода +2.
Степень окисления углерода +4.
В реакциях может быть восстановителем.
В реакциях может быть окислителем.
При пропускании через известковую воду наблюдается помутнение.
Обменяйтесь работами и проверьте взаимопроверку.
| Задания | Ответы |
| Вариант 1 | 1,2,3,7,10,11,12,14 |
| Вариант 2 | 1,2,5,8,9,13,15,16 |
Варианты ответов проецируются на экран:
Отметка «5» – 7-8правильных ответов
«4» – 6
«3» – 5
«2» – 4 и менее
По кластеру: А какие соединения предстоит изучить?
(Ответ: угольную кислоту и её соли)
Усвоение новых знаний.
«Открывание бутылки с газированной водой» (учитель предлагает открыть бутылку с газированной водой, которую только встряхнула, одному из учащихся). Учащийся отказывается…Почему? (польется).
Открывая бутылку газированного напитка мы сталкиваемся с нашей незнакомкой. Это она, угольная кислота. Как часто предательски вырывается она из бутылки, разбрызгиваясь вокруг. Это происходит от того, что молекулы её крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку, она сразу разлагается:
H2CO3=H2O + CO2
Это тот редкий случай вещества, формулу которого принято считать условной, т. е. такой молекулы не существует, однако возможно рассматривать не только свойства её соединений, но и собственные свойства этой кислоты. Итак, какова же тема нашего урока?
Тема урока «Угольная кислота и её соли» (записывают в тетрадь).
Какие цели мы поставим перед собой?
1 – познакомиться с угольной кислотой и ее свойствами;
2 – изучить свойства солей угольной кислоты;
3 – проследить взаимные переходы карбонатов и гидрокарбонатов;
4 – рассмотреть качественную реакцию на карбонат – ион.
5 – определить практическое значение карбонатов
6 – проанализировать нахождение карбонатов в природе, их происхождение
А как вы думаете могут ли пригодиться вам полученные знания и умения вам в практической деятельности и повседневной жизни? Да
Постановка и решение проблемного вопроса: Что вы будете наблюдать при длительном пропускании углекислого газа через дистиллированную воду, подкрашенную фиолетовым лакмусом? Предлагают варианты .
Подтвердить или опровергнуть наши предположения поможет эксперимент. Напоминаю, что при выполнении хим. Эксперимента необходимо соблюдать правила ТБ.
ОПЫТ. На столах у вас стаканы с дистиллированной водой и трубочки. Возьмите трубочки и выдыхайте в них воздух в стакан с водой. Добавьте немного лакмуса.
Вопросы:
1. Что наблюдаете? (Появление красноватой окраски раствора).
2.Почему это происходит? записывают уравнение реакции получения угольной кислоты СО2+Н2О = H2CO3
3. Какой вывод о силе угольной кислоты можно сделать? Вывод: угольная кислота является слабой, что подтверждает розовая окраска лакмуса, а не красная, как в растворах сильных кислот (сравнить с соляной).
Учитель: Угольная кислота самая распространенная кислота в природе. Как вы думаете почему?
Ученики: Так как образуется в результате взаимодействия СО2 с водой (Н2О занимает ¾ поверхности Земли, а СО2 - обязательный компонент атмосферы).
Учитель Дайте характеристику угольной кислоте по изученным признакам:
(кислородсодержащая, двухосновная, слабая, летучая).
Учитель: запишите на доске процесс диссоциации данной кислоты
H2CO3↔ H+ + HCO3-
HCO3-↔ H+ + CO3-2
Учитель: исходя из данной схемы образуются ионы 2-х видов. Как они называются?
Ученик: Карбонат-ион и гидрокарбонат-ион.
Учитель: Какие два ряда солей будет образовывать угольная кислота? (Кислые и средние).
2. Стадия осмысления (получение новой информации)
Задание 1. Возьмите на столах листы желтого цвета и выполните задание согласно номеру группы.
Запишите формулы средних и кислых солей:
Группа: составить формулу гидрокарбоната кальция. Определить степени окисления элементов. Составить уравнение диссоциации данной соли.
Группа: составить формулу карбоната кальция. Определить степени окисления элементов. Составить уравнение диссоциации данной соли.
Группа: составить формулу гидрокарбоната натрия. Определить степени окисления элементов. Составить уравнение диссоциации данной соли.
После выполнения вызов по 1 представителю от ряда к доске.
Учитель обращает внимание, что данные знания и умения проверяются в заданиях ОГЭ.
Задание 2. А давайте сравним растворимость этих солей.
Что поможет нам ответить на этот вопрос? На столах таблицы растворимости. Ваше задание – раскрасить синим цветом растворимые карбонаты и гидрокарбонаты (работа с таблицей растворимости. Вывод: из карбонатов растворимы только соли K+, Na+, NH4+), гидрокарбонаты все растворимы).
Учитель: Хорошо, молодцы! Отложите свои таблицы. Выполните следующее задание:
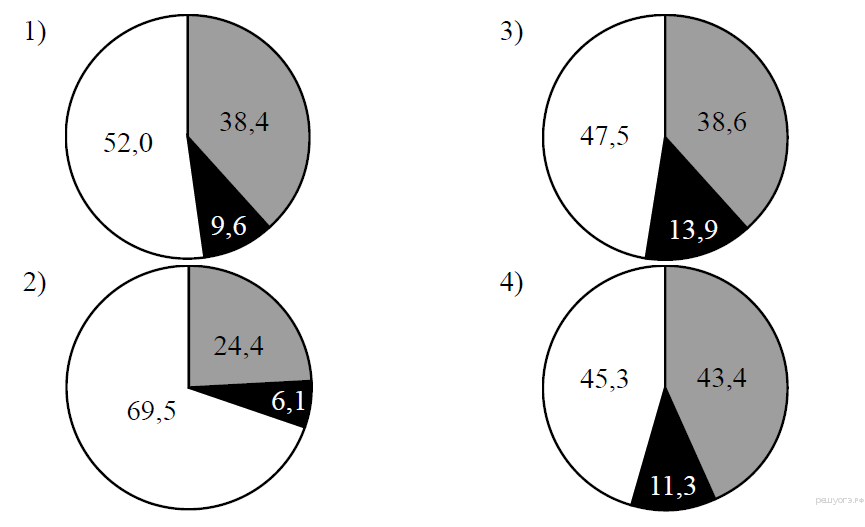
Задание 3. ОГЭ Определите на какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната натрия?
Один у доски.
ФИЗМИНУТКА
Учитель: мы проделали большую работу я предлагаю немного отдохнуть. Встряхните кисти, повращайте головой, закройте глаза.
Учитель: Продолжаем работать. Предложите гипотезу и план исследования солей угольной кислоты. При составлении плана воспользуйтесь параграфом учебника. Стр. 245-247.
Давайте сверим ваш план с эталоном.
Гипотеза: а) соли угольной кислоты обладают общими свойствами солей;
б) должны обладать специфическими свойствами.
План исследования:
1) Исследовать отношение к солям;
2) к кислотам;
3) взаимопревращения средних и кислых солей.
Выполните ЛО согласно инструктивным картам на синих листах. Соблюдайте правила ТБ. Работа в группах (3 группы). Обсуждение результатов.
? разложение при нагревании.
| Выполните лабораторные опыты по группам согласно инструкции (на столах обучающихся). Соблюдайте правила по ТБ. Задание для 1 группы. Задание для 2 группы. Задание для 3 группы. | 1 . При добавлении НСL к кристаллической соли СаСО3 и раствору питьевой соды NаHСО3 происходит бурное «вскипание» в обеих пробирках за счёт выделения СО2. В 1-ой пробирке соль СаСО3 растворилась. Поэтому эти реакции можно считать качественными. 2 . При добавлении к Nа2СО3 (р-р) ВаС12 и КС1, только в первой пробирке образовался осадок за счёт того, что получилась нерастворимая соль BаСО3. 3. При пропускании СО2 через известковую воду, она сначала помутнела за счёт образования нерастворимой соли СаСО3, а при дальнейшем пропускании СО2 муть исчезла, т.к. соль растворилась и получился растворимый гидрокарбонат кальция. |
ОГЭ задание части С: Даны вещества: NaOH, CaO, CuO, Na2CO3, Na2CO3, AgNO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии карбонат кальция. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции. ( напечатаны и выполнить дома).
Учитель: я думаю, вы уже поняли, что соли угольной кислоты широко распространены в природе и участвуют во многих химических процессах. А теперь я предлагаю вам в группах поработать с предложенными текстами, из которых вы узнаете о значении и применении карбонатов и гидрокарбонатов в повседневной и практической деятельности человека (приложение3)
После работы с текстами вам предстоит сообща заполнить следующие таблицы
Таблица 1. Практическое значение природных карбонатов
| Формула | Химическое название | Техническое название | Области применения |
| Na2CO3 |
|
|
|
| NaHCO3 | Гидрокарбонат натрия |
|
|
| K2CO3 |
|
|
|
| CaCO3 |
|
|
|
Подведение итогов.
Учитель: Давайте подведем итог. Угольная кислота и ее соли во многом формируют облик планеты. Они находят широкое применение и в хозяйственной деятельности человека. Особое значение в истории цивилизации имеет карбонат кальция. Это ему мы обязаны архитектурным обликом наших городов. Но для того, чтобы карбонаты работали на человека, требуется знание научных закономерностей, в первую очередь химических процессов, протекающих вокруг нас. И бережное отношение к природе.
Закрепление знаний. А теперь проверим как вы усвоили материал. На белых листах у вас на столах задания.
Напишите уравнения практически осуществимых реакций (выводится на доску) № 1. Уровень А. на отметку «3»
Закончите уравнения осуществимых химических реакций (любые 2)
CO 2+ NaOH =
С O2+ Na2O =
CO2+ Ca(OH)2 =
H2CO3+ Na2SO4 =
CaCO3+ CO2 + H2O =
№ 2. Уровень В. На отметку 4-5:
Составьте уравнения реакций по схеме(любую 1)
1) Ca → CaC 2→ Ca ( OH )2→ CaCO 3→ CO 2→ C
2) CO2 → H2CO3 → Na2CO3 → CO2
Информирование о домашнем задании.
Откройте дневники, запишите д/з.(или распечатать заранее).
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
V. Рефлексия
Верите ли вы, что…
1. Угольная кислота – сильный электролит.
2. Угольная кислота образует кислые и средние соли.
3. Карбонат кальция – основа мела, известняка малахита.
4. Для распознания карбонат ионов используют взаимодействие с ионами водорода сильных кислот.
я познакомился с ...
было непросто ...
я добился ...
у меня получилось ...
мне понравилось ...
мне запомнилось ...
я попробую ...
А сейчас мы представляем вашему вниманию отчет творческой группы, которые к сегодняшнему уроку получили задание решить проектную задачу «Лимонад в домашних условиях»
Итоги урока. Учащиеся получают в подарок рецепт Домашнего лимонада:
Углекислый газ в напитках увеличивает их освежающее действие. Ты можешь в любое время приготовить пенящийся лимон. Для этого надо: Лимонной кислоты 12 ч л, сахарной пудры 4 ст л, сода пищевой 6 ст л.
Приготовление: Сначала приготовим порошковую смесь:
Для этого возьмем совершенно сухую емкость, для верности ее лучше дополнительно протереть.
Насыпаем сначала соду, затем лимонную кислоту и хорошо перемешиваем ложкой до полной однородности.
Соду лучше брать из новой пачки, чтобы она наверняка была сухой и без комков.
Добавляем к полученной смеси сахарную пудру и вновь хорошо перемешиваем. Делать это можно металлической ложкой, но удобнее будет использовать деревянную палочку, как для мороженого.
Пересыпаем полученный порошок в банку с крышкой и убираем в темное сухое место.
Доставая по мере необходимости, храним до 1 месяца.
Готовим лимонад из расчета 1 ч.л. с горкой сухой смеси на 200 мл холодной воды. Сахар по желанию добавляем дополнительно. Насыпаем сначала порошок, затем наливаем ½ стакана жидкости и хорошо перемешиваем до полного растворения. Затем доливаем оставшийся объем и подаем.
Учащиеся получают в подарок рецепт Домашнего лимонада
Спасибо за урок.
Если осталось время: Задание (из ГИА задание части С): Какой объем углекислого газа образуется при взаимодействии 130 г 56% соляной кислоты с карбонатом натрия?
Текст для группы 1
Карбонаты в виде известняков используют при строительстве. При обжиге известняка образуется оксид кальция, или негашёная известь:
СаС03 = СаО + С02.
При добавлении к оксиду кальция воды образуется гашёная известь:
СаО + Н20 = Са(ОН)2.
Гашёную известь используют при строительстве для побелки, штукатурки, при этом для прочности добавляют песок. Гидроксид кальция, реагируя с углекислым газом воздуха, превращается в карбонат кальция и постепенно твердеет.
Многие памятники скульптуры и архитектуры сделаны из известняка и мрамора. Вы, наверное, знаете, что за последние десятилетия они начали сильнее разрушаться, чем за всё предыдущее время. Это происходит под воздействием кислотных дождей. Кислоты получаются при взаимодействии в атмосфере оксидов азота и серы, образующихся при сжигании различных видов топлива, с водой. Под воздействием этих кислот из памятников культуры вымываются карбонаты:
СаС03 + H2S04 = CaS04 + С02 + Н20.
В последнее время для их защиты используют покрытия из высокомолекулярных соединений — силиконов.
| Химическая формула | Химическое название | Техническое название | Области применения |
| Na2CO3 |
|
|
|
| NaHCO3 |
|
|
|
| K2CO3 |
|
|
|
| CaCO3 |
|
|
|
Текст для группы 2 Вода в природе бывает мягкая и жёсткая. Жёсткой называют воду, содержащую различные соли. Различают временную и постоянную жёсткость. Временная жёсткость обусловлена присутствием растворимых гидрокарбонатов кальция и магния — Са(НС03)2 и Mg(HC03)2. Данные соли разрушаются при кипячении, поэтому такую жёсткость и называют временной. Постоянная жёсткость обусловлена присутствием других солей, например сульфатов (CaS04) и хлоридов (СаС12). Использование в быту воды с повышенной жёсткостью приводит к дополнительным материальным и энергетическим затратам. Например, при кипячении такой воды на стенках посуды образуется постепенно толстый слой накипи, образованной нерастворимыми карбонатами кальция и магния: Са(НС03)2 = СаС03 + Н20 + С02. Чем больше слой накипи, тем дольше закипает чайник. При стирке в жёсткой воде расходуется больше стиральных средств, в частности мыла. При этом часть мыла тратится на связывание ионов кальция и магния, в результате этого образуются нерастворимые соединения кальция и магния, которые выпадают в осадок.
В настоящее время для стирки используют синтетические моющие средства, эффективность которых мало зависит от жёсткости воды. Однако синтетические моющие средства медленно разрушаются в природной среде и вызывают загрязнение водоёмов.
Смягчить воду можно химическим путём. Для этого в жёсткую воду добавляют соду Na2C03 или известковую воду Са(ОН)2, при этом карбонат кальция выпадает в осадок. Временную жёсткость устраняют также кипячением. Как влияет жёсткая вода на организм человека? Хотя ионы кальция и магния играют важную роль в водно-солевом балансе организма, их избыток может привести к нарушению обмена веществ и развитию заболеваний, например почечно-каменной болезни.
Наши прабабушки старались умывать лицо, мыть волосы талой или дождевой водой, которая содержит очень малое количество солей. Такая вода не сушит кожу, и волосы после мытья мягкие и блестящие. Обратите внимание, что в составе кремов присутствует умягчённая вода, а шампуни, пены для ванн обязательно содержат смягчители воды.
Овощи, мясо, сваренные в мягкой воде, гораздо вкуснее и сочнее. Жёсткую воду не рекомендуют использовать для приготовления пищи, так как она снижает вкусовые качества блюд.
| Химическая формула | Химическое название | Техническое название | Области применения |
| Na2CO3 |
|
|
|
| NaHCO3 |
|
|
|
| K2CO3 |
|
|
|
Текст для группы 3.
Карбонаты применяют в производстве стекла. Сырьём для получения обычного стекла служат чистый кварцевый песок, сода и известняк. Эти вещества тщательно перемешивают и подвергают сильному нагреванию (до 1500 °С). При этом протекают реакции:
Na2C03 + Si02 = Na2Si03 + C02↑;
CaC03 + Si02 = CaSi03 + C02↑.
Расплавленное стекло охлаждается постепенно, и ему можно придать различную форму.
Известняк и глина, содержащая оксид кремния, служат основным сырьём для производства цемента. Эти вещества тщательно перемешивают и обжигают смесь в наклонных цилиндрических печах, длина которых достигает 200 м, а диаметр составляет около 5 м. В процессе обжига печь медленно вращается, исходные материалы постепенно движутся, при этом между глиной и известняком происходят сложные реакции. Образовавшиеся вещества спекаются в куски, после охлаждения их размалывают до тонкого порошка. Цемент широко используют в строительстве как связующий материал.
Гидрокарбонаты аммония и натрия применяют в кондитерском деле, они легко разлагаются при нагревании, образуя газы, разрыхляющие тесто и делающие его пышным:
NH4HC03 = NH3 + Н20 + С02; 2NaHC03 = Na2C03 + Н20 + С02.
Карбонат натрия, или соду, используют в огнетушителях. Огнетушитель представляет собой стальной баллон, заполненный раствором соды. Сверху помещена ампула с серной кислотой. Когда огнетушитель приводят в действие, ампула разбивается, серная кислота реагирует с карбонатом натрия, начинает выделяться углекислый газ и образуется пена. Пена прекращает доступ кислорода к горящему предмету, и таким образом происходит тушение пожара.
| Химическая формула | Химическое название | Техническое название | Области применения |
| Na2CO3 |
|
|
|
| NaHCO3 |
|
|
|
| K2CO3 |
|
|
|
| CaCO3 |
|
|
|
Группа 1. Лабораторный опыт № 1.
Взаимодействие карбонатов и гидрокарбонатов с кислотами.
Соблюдайте правила техники безопасности при проведении опытов при работе с кислотами.
1.Пробирка № 1 САСО3 мел, приливаем раствор соляной кислоты пробирка № 3.
Что происходит? Результат опыта опишите в тетради, составьте уравнение реакции.
СаСО3 + НСl = (шипение, бурление)
2. Пробирка № 2 NaHCO3 питьевая сода, приливаем раствор соляной кислоты пробирка № 3.
Что происходит? Результат опыта опишите в тетради, составьте уравнение реакции.
NaHCO3 + HCl = (шипение, бурление)
__________________________________________________________
Группа 2. Лабораторный опыт № 2.
Взаимодействие растворимых карбонатов с другими растворимыми солями.
Соблюдайте правила техники безопасности при проведении опытов.
1. Пробирка № 1 раствор К2СО3 , приливаем раствор ВаCl2 пробирка № 2.
Что происходит? Результат опыта опишите в тетради, составьте уравнение реакции.
К2СО3 + ВаCl2 = (выпадение осадка)
_________________________________________________________________
Группа 3. Лабораторный опыт № 3.
Взаимодействие известковой воды с углекислым газом.
Пробирка № 1 известковая вода Са(ОН)2 , осторожно вдувать выдыхаемый воздух в данный раствор (опустить конец стеклянной трубки в раствор и дуть в трубку, не вдыхать в себя!).
Что происходит? Результат опыта опишите в тетради, составьте уравнение реакции.
Са(ОН)2 + СО2 = (помутнение )
СаСО3 + СО2 +Н2О = (исчезновение мути)
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
1. Д/З (на слайде): §34,
2. (Денисов, Пычина, Хрупин) записывают №5 стр 249
3. Все остальные №6 (под а) или б) на выбор) – генетическая цепочка + №7 - задача на нахождение массовой доли вещества в растворе.
4. Подготовить сообщения:
а) что такое жесткость воды, чем она вызвана и как её можно устранить;
б) сообщение о жемчуге,
в) сообщение об образовании сталактитов и сталагмитов.
5.Решить проектные задачи на выбор:
а) «Почему при изжоге пьют соду?»;
б) «Мини-огнетушитель».
я познакомился с ...
было непросто ...
я добился ...
у меня получилось ...
мне понравилось ...
мне запомнилось ...
я попробую ...
я познакомился с ...
было непросто ...
я добился ...
у меня получилось ...
мне понравилось ...

























