
Подумаем!
- В природе ¾ объёма поверхности Земли занимает H 2 O, а CО 2 - обязательный компонент атмосферы. Какой это оксид по классификации? Что он образует с Н 2 О.
- Составить уравнения реакций взаимодействия углекислого газа с водой и дать характеристику этой реакции.
CO 2 + H 2 O ↔ H 2 CO 3

Угольная кислота и её соли
Тема урока
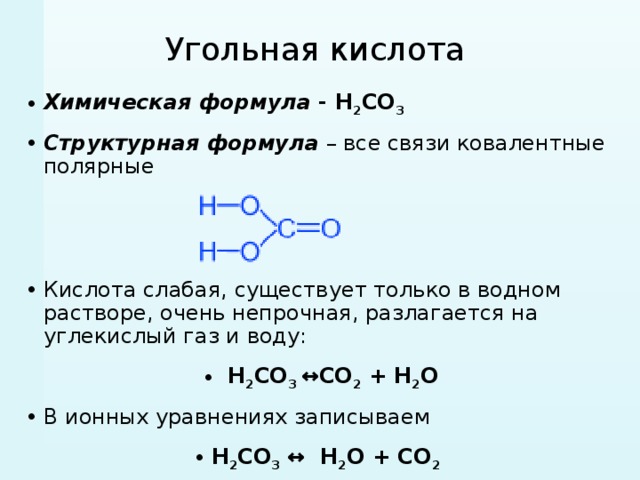
Угольная кислота
- Химическая формула - H 2 CO 3
- Структурная формула – все связи ковалентные полярные
- Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
- H 2 CO 3 ↔CO 2 + H 2 O
- В ионных уравнениях записываем
- H 2 CO 3 ↔ H 2 O + CO 2
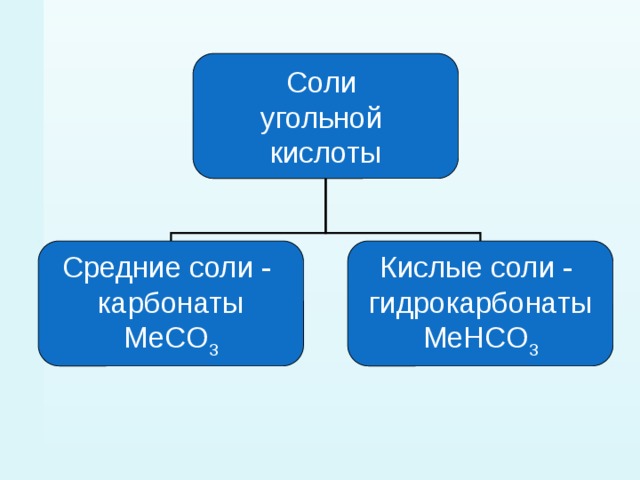
Соли
угольной
кислоты
Средние соли -
Кислые соли -
карбонаты
гидрокарбонаты
MeCO 3
MeHCO 3
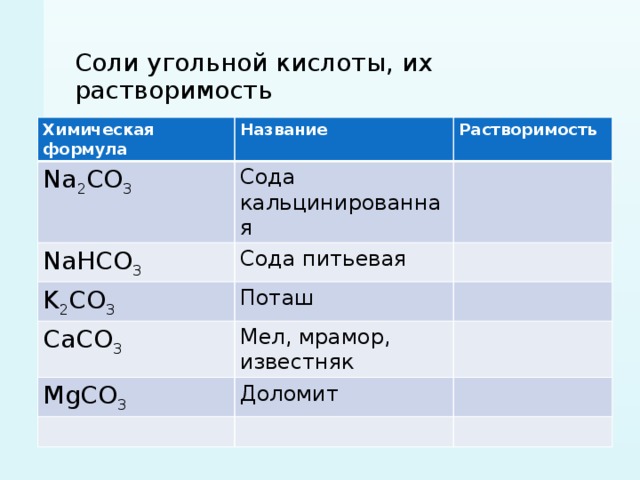
Соли угольной кислоты, их растворимость
Химическая формула
Название
Na 2 CO 3
Растворимость
Сода кальцинированная
NaHCO 3
Сода питьевая
K 2 CO 3
Поташ
CaCO 3
Мел, мрамор, известняк
MgCO 3
Доломит
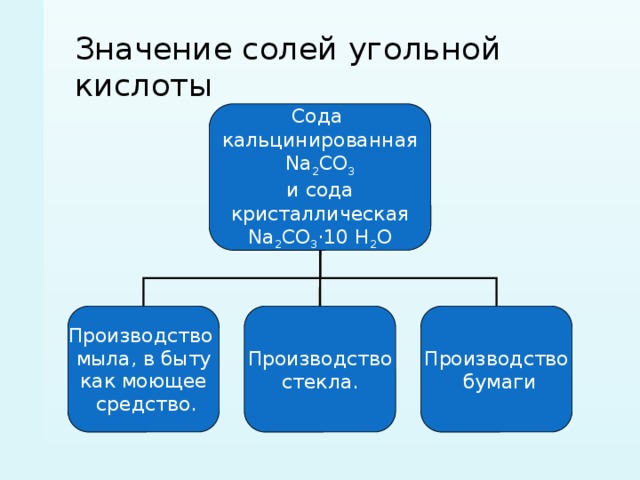
Значение солей угольной кислоты
Сода
кальцинированная
Na 2 CO 3
и сода
кристаллическая
Na 2 CO 3 ·10 H 2 O
Производство
Производство
Производство
стекла.
бумаги
мыла, в быту
как моющее
средство.
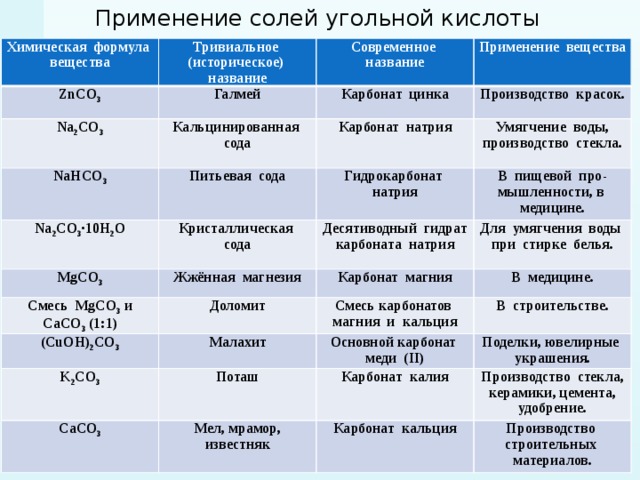
Применение солей угольной кислоты
Химическая формула вещества
Тривиальное (историческое) название
ZnCO 3
Современное название
Галмей
Na 2 CO 3
Применение вещества
NaHCO 3
Карбонат цинка
Кальцинированная сода
Питьевая сода
Производство красок.
Na 2 CO 3 ·10H 2 O
Карбонат натрия
MgCO 3
Кристаллическая сода
Умягчение воды, производство стекла.
Гидрокарбонат натрия
В пищевой про-мышленности, в медицине.
Десятиводный гидрат карбоната натрия
Смесь MgCO 3 и CaCO 3 (1:1)
Жжённая магнезия
(CuOH) 2 CO 3
Доломит
Для умягчения воды при стирке белья.
Карбонат магния
В медицине.
Смесь карбонатов магния и кальция
Малахит
K 2 CO 3
В строительстве.
Основной карбонат меди (II)
Поташ
CaCO 3
Поделки, ювелирные украшения.
Карбонат калия
Мел, мрамор, известняк
Производство стекла, керамики, цемента, удобрение.
Карбонат кальция
Производство строительных материалов.

Карбонаты в скульптуре и архитектуре
Парфенон (5 век до н.э. Афины)
Ника Самофракийская
(11 век до н.э. Лувр. Париж)

Химические свойства карбонатов и гидрокарбонатов
1) Качественная реакция на CO 3 2- карбонат – ион "вскипание" при действии сильной кислоты :
СаCO 3 + 2HCl = СaCl 2 + H 2 O + CO 2 ↑
NaНCO 3 + HCl = NaCl + H 2 O + CO 2 ↑
2) Вступают в реакции обмена с другими растворимыми солями
Na 2 CO 3 + CaCl 2 = CaCO 3 ↓ + 2NaCl
3) Разложение гидрокарбонатов и карбонатов при нагревании
NaHCO 3 t˚C → Na 2 CO 3 + H 2 O + CO 2 ↑
CaCO 3 t˚C → CaO + CO 2 ↑ (исключ. карбонаты металлов I A гр.)
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга
СаСО 3 + СО 2 + Н 2 О = Са(НСО 3 ) 2
- Гидрокарбонаты обуславливают временную жесткость воды

Способы устранения временной жесткости воды
1. Кипячение
При кипячении растворимые гидрокарбонаты кальция и магния превращаются в нерастворимые карбонаты.
2. Добавление соды (Na 2 CO 3 )
Устраняется не только временная, но и постоянная жесткость воды, создаваемая хлоридами и сульфатами кальция и магния.
Задание:
Напишите молекулярные уравнения соответствующих реакций.
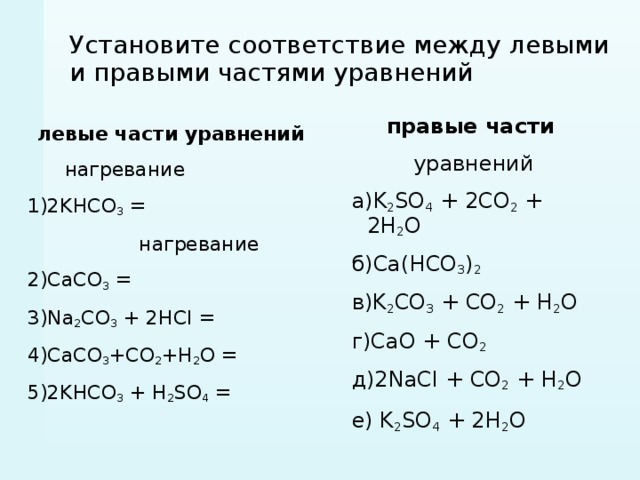
Установите соответствие между левыми и правыми частями уравнений
правые части
уравнений
а)K 2 SO 4 + 2CO 2 + 2H 2 O
б)Ca(HCО 3 ) 2
в)K 2 CO 3 + CO 2 + H 2 O
г)CaO + CO 2
д)2NaCI + CO 2 + H 2 O
е) K 2 SO 4 + 2H 2 O
левые части уравнений
нагревание
1)2KHCO 3 =
нагревание
2)CaCO 3 =
3)Na 2 CO 3 + 2HCI =
4)СaCO 3 +CO 2 +H 2 O =
5)2KHCO 3 + H 2 SO 4 =

ответы

Давайте проверим
ответы
1 - в
2 - г
3 - д
4 - б
5 - а
Оценки:
«5»- нет ошибок;
«4»- 1 ошибка;
«3» - 2 ошибки;
«2» - 3 ошибки

Здесь, среди миллионов кристаллов кальцита и арагонита человеку сложно понять,
какие силы природы смогли создать это каменное чудо.
Дождевая вода, просачиваясь через свод известняковой пещеры, растворяет в себе содержащийся в горной породе известняк. Разумеется, вода не стекает со свода пещеры ручьём, а очень медленно капает, настолько медленно, что часть её успевает испариться, а растворённый в ней известняк снова кристаллизуется в виде свисающих с потолка каменных «сосулек». Так образуются сталактиты. Упавшие вниз капли известковой воды тоже испаряются, а растворённый в них известняк остаётся в месте падения капель, образуя вертикальные конусообразные наросты – сталагмиты.
взаимопревращения в природе Пещера «Эмине-Баир-Хосар» в Крыму!

Сталактиты и сталагмиты в пещере Авшалом, Израиль

Сталактиты и сталагмиты в пещере Авшалом, Израиль

Тест по теме угольная кислота
1. Какая характеристика не относится к угольной
кислоте:
1) нестабильная 2) двуосновная 3) сильная
2. Формула питьевой соды:
1) NаНСО 3 2) Са(НСО 3 ) 2 3) Nа 2 СО 3
3.Вещество, с помощью которого распознают карбонаты:
1) Са(ОН) 2 2 ) Н Сl 3) ВаСl 2
4. Условие, необходимое для разложения карбонатов:
1) температура
2) давление
3) свет
5. Где применяется питьевая сода?
1) в кондитерском деле
2) в строительстве
3) в производстве стекла

Давайте проверим
Оценки: «5»- нет ошибок;
«4»- 1 ошибка;
«3»- 2 ошибки

Домашнее задание
- Изучить параграф в учебнике.
- Составьте уравнения реакций по схеме:
- 1) Ca → CaC 2 → Ca ( OH ) 2 → CaCO 3 → CO 2 → C
- 2) CO 2 → H 2 CO 3 → Na 2 CO 3 → CO 2
Какой объём и масса углекислого газа выделится при обжиге карбоната кальция массой 400 г.












































