Класс 9
Тема урока: Угольная кислота и её соли, их физические и химические свойства, получение и применение.
Предметные: Рассмотреть состав, строение, свойства, применение угольной кислоты и ее солей, круговорот углерода в природе. Закрепить знания о средних и кислых солях на примере карбонатов и гидрокарбонатов, их взаимопревращениях. Закрепить умение составлять уравнения реакций. Изучить качественную реакцию на углекислый газ и карбонат – ион. Ознакомить с практическим применением карбонатов и гидрокарбонатов.
Метапредметные: Продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении предложенных заданий. Развивать наблюдательность, память, умение сравнивать.
Личностные: Продолжить развитие познавательных интересов учащихся. Воспитывать культуру речи, трудолюбие, усидчивость. Воспитание положительного отношения к знаниям, инициативности, способности преодолевать трудности для достижения цели.
Формировать УУД:
Оборудование: учебник, тетрадь, таблица Менделеева, презентация, видеоролики, таблица растворимости. Штатив с пробирками, индикаторы.
Реактивы: мел, сода, соляная кислота, гидроксид натрия, хлорид кальция, карбонат натрия,
Ход урока
1.Организационный момент
Организация внимания и порядка в классе, взаимное приветствие, проверка присутствующих, проверка готовности класса к уроку.
2. Мотивация
Вот опять звенит звонок - начинается урок.
Входим дружно все мы в класс: урок химии у нас.
Первым делом гоним лень,
На уроке не молчать,
Всем работать, отвечать!
В мире много, интересного,
Нам порою неизвестного.
Миру знаний нет предела. Так скорей, друзья, за дело!
(Эмоциональный настрой)
Цитата к уроку:
“Сами, трудясь, вы сделаете все и для близких, и для себя, а если при труде успеха не будет, будет неудача – не беда, пробуйте еще”. Д.И. Менделеев
3.Актуализация знаний, обучающихся:
Учитель:
Какие соединения образует углерод?
Какой высший оксид образует углерод?
Какие соединения углерода мы уже изучили?
А какие соединения предстоит изучить?
(Ответ: угольную кислоту и её соли)
Фронтальная беседа:
Формула и названия угарного газа
Симптомами отравления газом
Сильная головная боль и головокружение (голова как бы «стянута обручем»).
Шум в ушах.
Темнеет в глазах.
Тошнота.
Мышечная слабость, дрожь во всем теле.
Потеря сознания
Свежий воздух
Расстегните ворот и стягивающую одежду.
Обеспечьте покой и непрерывный доступ свежего воздуха.
Вызовите скорую медицинскую помощь по телефону «103».
Разотрите энергичными движениями тело пострадавшего.
На голову и грудь положите холодный компресс.
Если пострадавший в сознании, напоите его теплым чаем, кофе.
Он поступает в кровь человека в 200 раз быстрее кислорода и «перехватывает» у него инициативу. Угарный газ в несколько раз легче и активнее вступает в связь с гемоглобином, который в результате этого теряет способность переносить кислород в ткани, в том числе в жизненно важные — мозг, легкие, сердце. От недостатка кислорода и наступает удушье. И если Вы дышите воздухом с высоким содержанием угарного газа, то смерть может произойти через несколько минут.
Угарный газ выделяется при пожарах, в банях, в дачных и сельских домах с печным отоплением, на городской кухне при неполном сгорании природного газа.
Угарный газ может исходить из любого источника, работающего на горючем топливе. Легковые автомобили, камины, катера, дровяные, керосиновые обогреватели, древесно-угольные грили и газовые устройства, использующиеся в нагревателях воды, печах, сушилках.
4.Постановка цели урока
Демонстрация «Открывание бутылки с газированной водой»
Учитель:
Открывая бутылку лимонада или любого другого газированного напитка, мы сталкиваемся с нашей незнакомкой. Это она, угольная кислота. Любая газированная вода представляет собой раствор углекислого газа в воде.
Открывая бутылку газированной воды, мы видим, как выделяется газ, разбрызгиваясь вокруг. Это происходит от того, что молекулы угольной кислоты крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку, она сразу разлагается, выделяя углекислый газ.
Учитель:
Что образуется при растворении углекислого газа в воде?
Назовите формулу угольной кислоты.
Составляют уравнение реакции угольной кислоты
H2CO3=H2O + CO2
5. Физминутка.
6.Изучение нового материала
Химическая формула - H2CO3
Структурная формула – все связи ковалентные полярные: 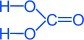
Характеристика угольной кислоты составляется в ходе беседы с классом. Учащиеся классифицируют угольную кислоту по известным признакам, записывают уравнения диссоциации по ступеням.
Как электролит – очень слабая кислота, диссоциирует на ионы в малой степени, поэтому изменяет окраску индикатора слабо.
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
H2CO3 ↔ CO2 + H2O
Для угольной кислоты характерны все свойства кислот
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор - лакмус краснеет в водном растворе:
H2CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
Соли угольной кислоты – карбонаты и гидрокарбонаты
Учитель: так как угольная кислота двухосновная, то ей соответствуют соли двух типов.
Учитель: Дайте названия этим солям
Ответы учащихся: (Карбонат кальция) и (Гидрокарбонат кальция)
Учитель: Что можно сказать о растворимости карбонатов и гидрокарбонатов?
(работа с таблицей растворимости)
Ответы учащихся: растворимы только соли K+, Na+, NH4+ , гидрокарбонаты все растворимы в воде.
На демонстрационном столе карбонаты (учащиеся описывают физические свойства)
Физические свойства:
Оборудование: стакан с водой, карбонаты, стеклянная палочка.
Все карбонаты – твёрдые белые кристаллические вещества.
Большинство из них в воде не растворяются.
Гидрокарбонаты растворяются в воде (растворяют в воде).
Карбонаты в природе, область их применения:
презентация
CaCO3 - мел, мрамор, известняк
NaHCO3 – питьевая сода
K2CO3 -(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Химические свойства карбонатов
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями (демонстрация)
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
Учитель: При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Именно наличием этой соли и объясняется временная жесткость воды. Почему временная? Потому что, при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
Составляют уравнение реакции:
Ca (HCO3)2 → CaCO3↓ + CO2↑+H2O
Эта реакция приводит к образованию накипи на стенках котлов, домашних чайников.
Жёсткость воды
Использование жёсткой воды приводит к образованию накипи. Анализ показывает, что жёсткая вода содержит большое количество растворимых солей кальция и магния.
Жёсткость воды


временную жёсткость постоянную жёсткость
Ca(HCO3)2 и Mg(HCO3)2 СaCl2 и MgCl2
Временная жёсткость воды или карбонатная
обусловлена присутствием в воде гидрокарбонатов кальция и магния.
t
Ca(HCO3)2  Са СO3
Са СO3  + H2O + CO2
+ H2O + CO2
Ca(HCO3)2 +Ca(OH)2
Ca(HCO3)2 + Na2CO3
Постоянная или некарбонатная жёсткость
обусловлена присутствием в воде других растворимых солеё кальция или магния.
CaCl2+ Na2CO3 
Круговорот углерода в природе
7.Закрепление знаний:
Осуществить превращения и указать типы реакций:
C → CO→ CO2→H2CO3→Ca(OH)2 → CaCO3→ Ca(HCO3)2 → CaCO3→ CaCl2
8. Рефлексия учебной деятельности:
– Какую цель мы ставили на уроке?
– Вы достигли цели урока?
- Тема урока мне понятна
-Я доволен своей работой на уроке
- На самостоятельной работе у меня все получилось
мне было легко
я затруднялся
мне было трудно
Китайская мудрость гласит:
9.Домашнее задание: учить конспект, знать химические свойства угольной кислоты.


























