Просмотр содержимого документа
«Типы химических реакций»

Типы химических реакций
8 класс
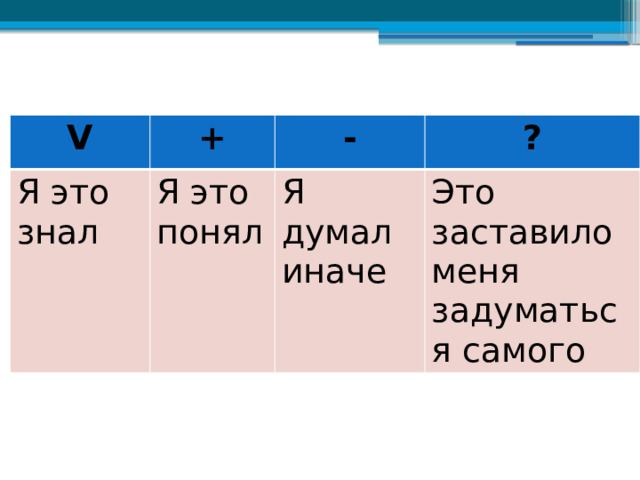
V
+
Я это знал
Я это понял
-
?
Я думал иначе
Это заставило меня задуматься самого
разложения
замещения
обмена
соединения
Типы реакций
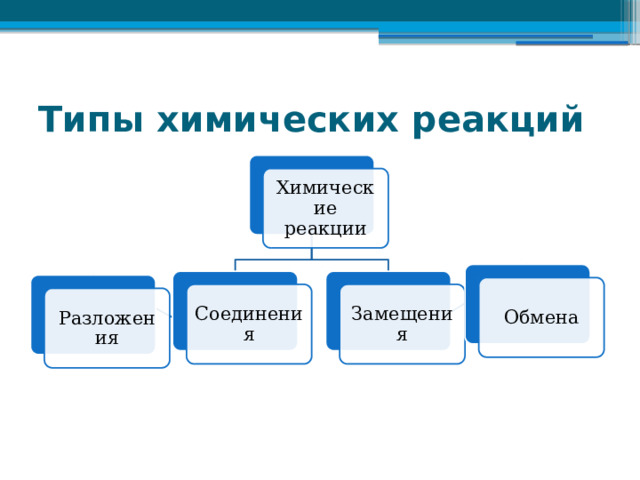
Типы химических реакций
Химические реакции
Обмена
Соединения
Замещения
Разложения

Опыт № 1 Взаимодействие меди с хлором. ( Cl 2 )
- Вопросы.
- Назовите признаки химических реакций, которые вы наблюдали?
- Какие условия необходимо создать для протекания реакции?
- Сколько веществ вступило в реакцию?
- Сколько веществ образовалось?

Опыт № 2 Разложение малахита (Cu OH) 2 CO 3

Опыт № 2 Разложение малахита (Cu OH) 2 CO 3
- Вопросы.
- Назовите признаки химических реакций, которые вы наблюдали?
- Какие условия необходимо создать для протекания реакции?
- Сколько веществ вступило в реакцию?
- Сколько веществ образовалось?

Взаимодействие железа с раствором сульфата меди(II)(CuSO 4 )
- Вопросы.
- Назовите признаки химических реакций, которые вы наблюдали?
- Сколько веществ вступило в реакцию?
- Сколько веществ образовалось?
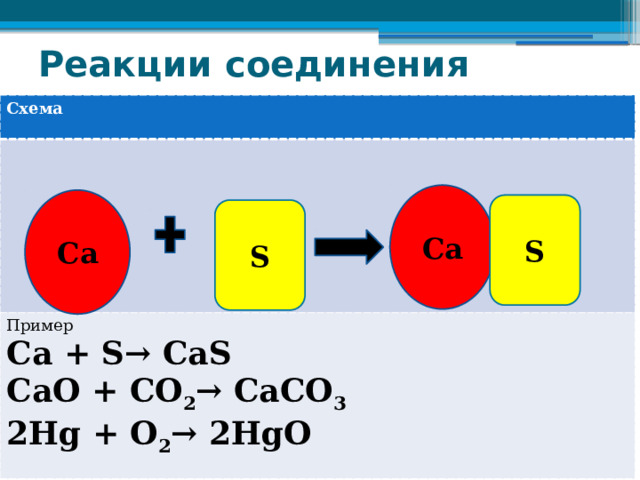
Реакции соединения
Схема
Пример
Са + S→ СаS
СаО + CO 2 → СаСО 3
2Hg + O 2 → 2НgО
Са
Са
S
S
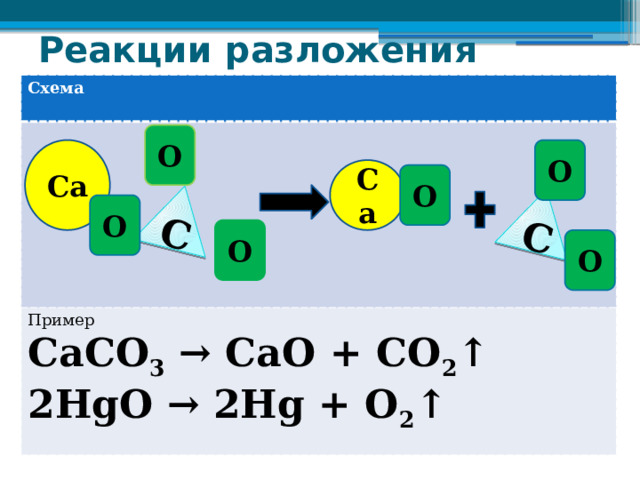
Реакции разложения
С
С
Схема
Пример
СаСО 3 → СаО + CO 2 ↑
2НgО → 2Hg + O 2 ↑
О
Са
О
Са
О
О
О
О
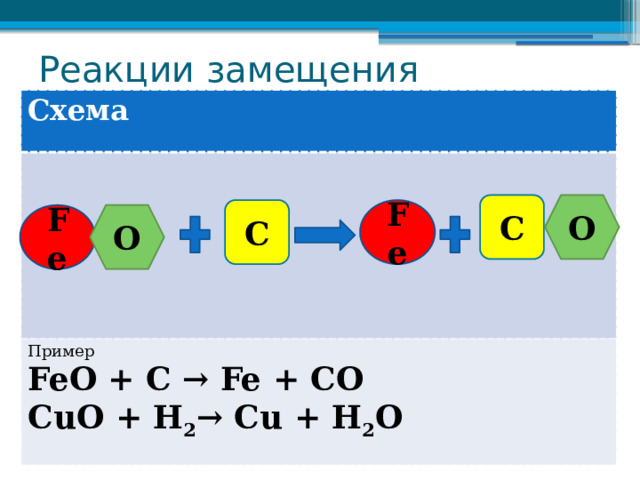
Реакции замещения
Схема
Пример
FeО + C → Fe + CO
СuО + H 2 → Сu + H 2 О
C
O
C
Fe
Fe
O

Реакции обмена
Схема
Пример
FeО + H 2 SO 4 → FeSO 4 + H 2 О
СаО + H 2 S → СаS + H 2 О
Н 2
S
O
S
Н 2
Са
O
Са

Задание №2:
Царь зовет к себе Стрельца – удалого молодца,
И дает ему поручение государственного значения:
«Чтоб я стал опять богат, нужен мне алюминия сульфид.
Ночь даю тебе подумать, утром буду ждать доклад.
Не смогешь – кого винить? Должен я тебя казнить.
- Запиши себе названье, чтоб со страху не забыть».
- Напишите в тетради формулу сульфида алюминия, уравнения реакции его получения. Укажите тип реакции.
- .

Задание №1:
- О каких веществах идет речь в отрывке из стихотворения С.Щипачева «Читая Менделеева»?
«Ты знаешь газ легчайший – водород (H 2 ).
В соединенье с кислородом (О 2 )– это
Июньский дождь от всех своих щедрот,
Сентябрьские туманы на рассвете!»
О каком веществе идет речь?
- Напишите формулы данных веществ. Составьте уравнение реакции разложения. Назовите каждое вещество.

Задание №3
- Жилец из квартиры №26 решил помочь освободиться жильцу из квартиры №29 из его сульфата, но сам попал в западню. Почему?
- Напишите уравнения реакции, определите тип реакции и поставьте коэффициенты.
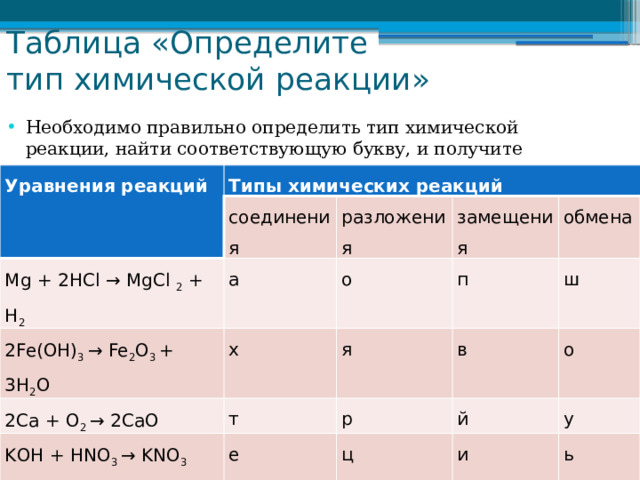
Таблица «Определите тип химической реакции»
- Необходимо правильно определить тип химической реакции, найти соответствующую букву, и получите слово.
Уравнения реакций
Типы химических реакций
с оедине ния
Mg + 2HCl → MgCl 2 + H 2
а
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O
р азложе ния
2Ca + O 2 → 2CaO
х
о
з амеще ния
п
т
я
обмена
KОН + НNO 3 → KNO 3 +Н 2 O
в
ш
р
е
й
о
ц
у
и
ь
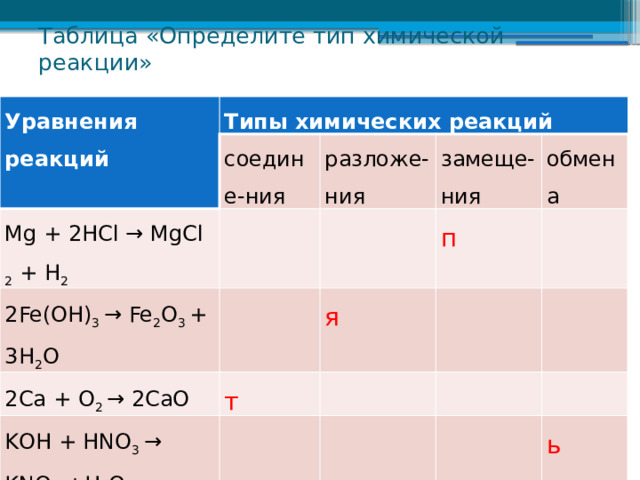
Таблица «Определите тип химической реакции»
Уравнения реакций
Типы химических реакций
с оедине- н и я
Mg + 2HCl → MgCl 2 + H 2
р азложе- ния
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O
з амеще- ния
2Ca + O 2 → 2CaO
обмена
п
я
т
KОН + НNO 3 → KNO 3 +Н 2 O
ь

Домашнее задание. § § 29-32, упр.1стр 155 после §29
сок
реакций в доме?
разложение
замещение
соединение
обмен












































