
Типы химических реакций
Составитель:
учитель химии
МКОУ «Рыбинской СШ»
Любакова Анна Николаевна

Цель урока
1 . Дать понятия о классификации химических реакций, о сущности реакций соединения, разложения, замещения и обмена.
2. Продолжить формирование умения записывать уравнения химических реакций, начать формировать умения предсказывать продукты реакций. Закреплять умения расставлять коэффициенты
3. Продолжить развивать у ребят навыки наблюдения, логического мышления, умения делать выводы и заключения.
4. Прививать интерес к предмету.
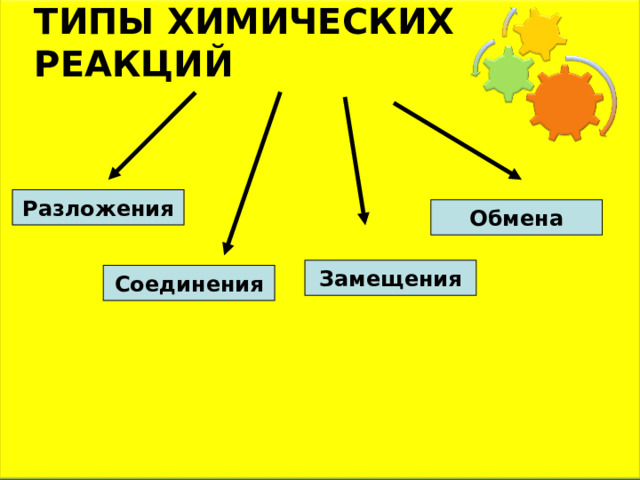
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Разложения
Обмена
Замещения
Соединения

П.П . Бажов «Малахитова шкатулка»

Реакция разложения малахита:
( CuOH) 2 CO 3 = 2CuO + H 2 O + CO 2
Малахит оксид вода оксид
меди ( II ) углерода ( IV)
- Малахит оксид вода оксид меди ( II ) углерода ( IV)
- Малахит оксид вода оксид меди ( II ) углерода ( IV)
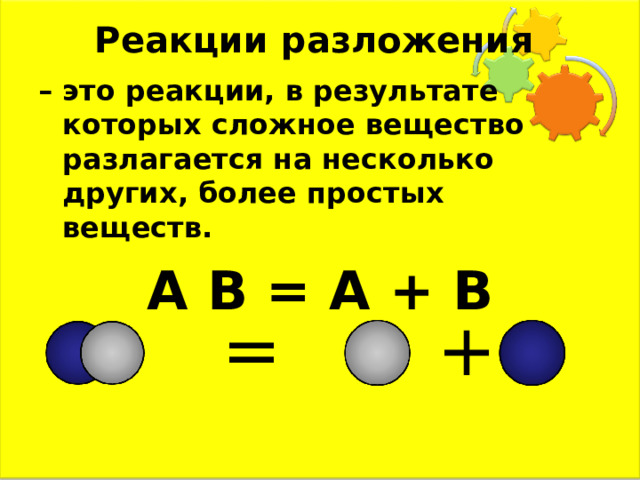
Реакции разложения
– это реакции, в результате которых сложное вещество разлагается на несколько других, более простых веществ.
А В = А + В
+
=

Признаки реакции разложения
- В реакции принимает участие только одно исходное сложное вещество
2. Образуется два и более новых как простых, так и сложных веществ
3. Как правило почти все реакции разложения будут эндотермические ( - Q) (нужна непрерывная подача тепла)

Реакция соединения
Cu + Cl 2 = CuCl 2
2Fe + 3Cl 2 = 2Fe Cl 3
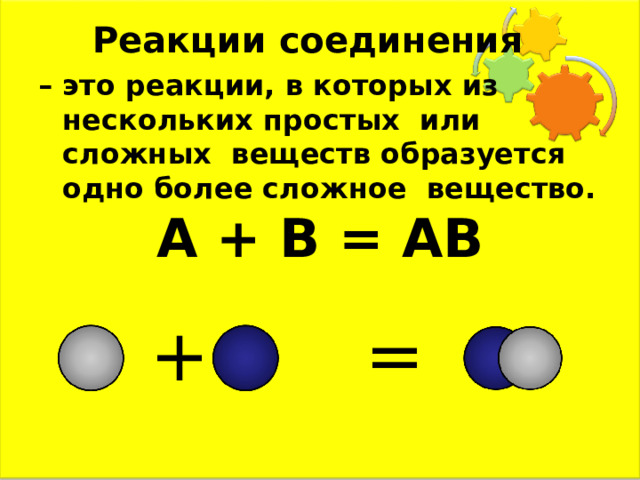
Реакции соединения
– это реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество.
А + В = АВ
+
=

Признаки реакции соединения
1 . В реакции участвуют два или более как простых, так и сложных веществ
2. Образуется одно сложное вещество
3. Как правило почти все реакции соединения будут экзотермические (+ Q)

Реакции замещения
Zn + H Cl = … + …
Zn + H Cl = Zn Cl 2 + H 2
Zn + 2 H Cl = Zn Cl 2 + H 2
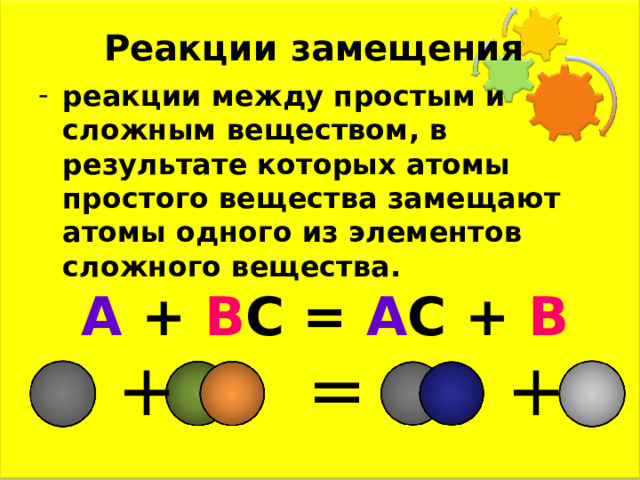
Реакции замещения
- реакции между простым и сложным веществом, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
А + В С = А С + В
+
+
=

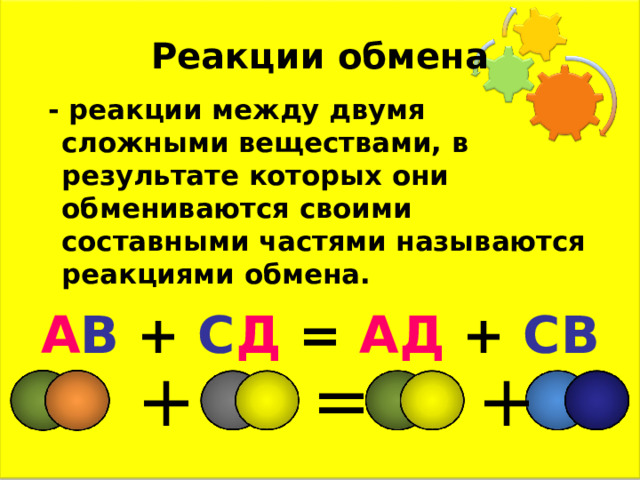
Реакции обмена
Cu O + H 2 SO 4 = CuSO 4 + H 2 O
Реакции обмена
- реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями называются реакциями обмена.
А В + С Д = АД + СВ
+
+
=
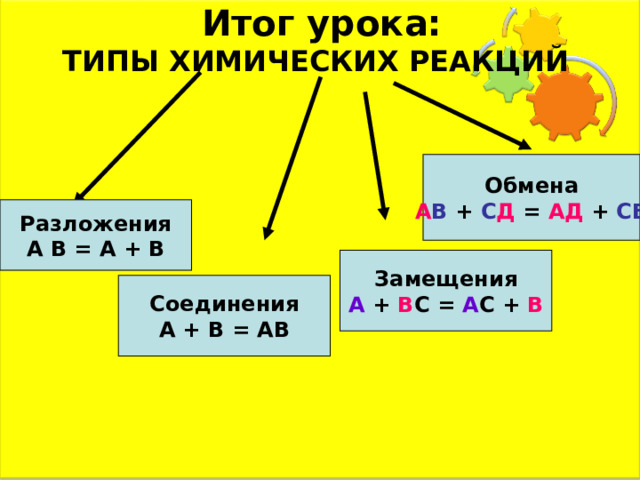
Итог урока: ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Обмена
А В + С Д = АД + СВ
Разложения
А В = А + В
Замещения
А + В С = А С + В
Соединения
А + В = АВ
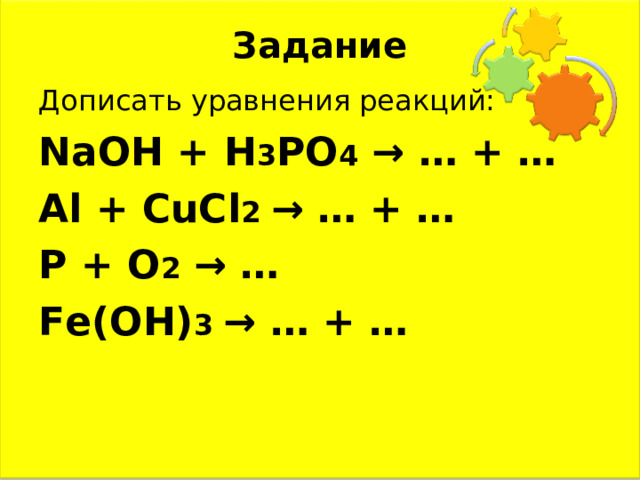
Задание
Дописать уравнения реакций:
NaOH + H 3 PO 4 → … + …
Al + CuCl 2 → … + …
P + O 2 → …
Fe(OH) 3 → … + …

Задание
Дописать уравнения реакций:
3NaOH + H 3 PO 4 = Na 3 PO 4 + 3H 2 O
2Al + 3CuCl 2 = 3 Cu + 2AlCl 3
4P + 5O 2 = 2P 2 O 5
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O

Определите тип реакции
1) CaO + CO 2 = CaCO 3
2) H 2 S O 4 + 2NaOH = Na 2 S O 4 + 2 H 2 O
3) Fe + S = FeS
4) 2H 2 O = 2 H 2 + O 2 ↑
5) CuO + H 2 = Cu + H 2 O
6) Zn + 2HCl = ZnCl 2 + H 2 ↑
7) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
8) Cu(OH) 2 = CuO + H 2 O
А) соединения
Б) обмена
В) разложения
Г) замещения
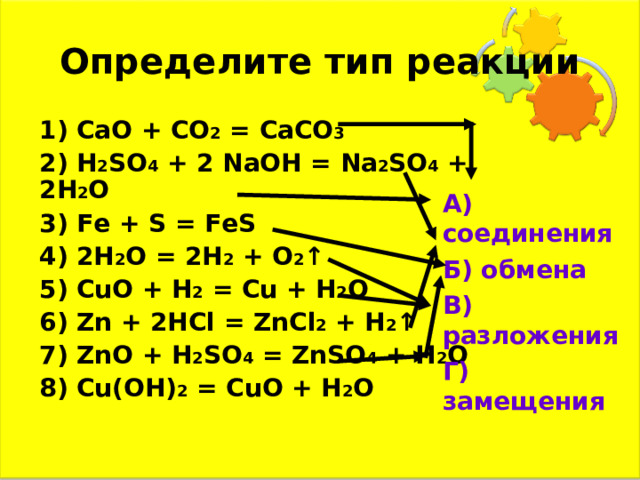
Определите тип реакции
А) соединения
Б) обмена
В) разложения
Г) замещения
1) CaO + CO 2 = CaCO 3
2) H 2 S O 4 + 2 NaOH = Na 2 S O 4 + 2 H 2 O
3) Fe + S = FeS
4) 2H 2 O = 2 H 2 + O 2 ↑
5) CuO + H 2 = Cu + H 2 O
6) Zn + 2HCl = ZnCl 2 + H 2 ↑
7) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
8) Cu(OH) 2 = CuO + H 2 O

Определите тип реакций и расставьте коэффициенты:
1) HgO → Hg + O 2
2) CaCO 3 → CaO + CO 2
3) CuSO 4 + Fe → Cu + FeSO 4
4) CuO + H 2 → Cu + H 2 O
5) H 2 + O 2 → H 2 O
6) H 2 SO 4 + KOH → K 2 SO 4 + H 2 O
7) BaO + SO 2 → BaSO 3

Определите тип реакций:
1) 2 HgO = 2 Hg + O 2 (разложение)
2) CaCO 3 = CaO + CO 2 (разложение)
3) CuSO 4 + Fe = Cu + FeSO 4 (замещение)
4) CuO + H 2 = Cu + H 2 O (замещение)
5) 2 H 2 + O 2 = 2 H 2 O (соединение)
6) H 2 SO 4 + 2 KOH = K 2 SO 4 + 2 H 2 O (обмена)
7) BaO + SO 2 = BaSO 3 (соединение)

Домашнее задание
Каждый ребенок получает индивидуальную карточку с заданием:
Расставить коэффициенты в приведенных схемах химических реакций и указать, к каким типам они относятся.


Список литературы:
О.С. Габриелян, химия 8 класс: учебник для общеобразовательных учреждений – М.: Дрофа, 2010 год
О.С. Габриелян, Т.В. Смирнова, изучаем химию в 8 классе: методическое пособие к учебнику – М.: «БЛИК и Ко», 2000 год
О.С. Габриелян, Настольная книга учителя химии 8 класс: методическое пособие к учебнику – М.: «БЛИК и Ко», 2001 год
Н.П. Гаврусейко, проверочные работы по неорганической химии: дидактический материал для 8 класса – М.: «Просвещение» 1992 год
Р.П. Суровцева, С.В. Софронов, задания для самостоятельной работы по химии в 8 классе – М.: «Просвещение», 1993 год
Г.Е. Рудзитис, Ф.Г.Фельдман, Электронное приложение к учебнику химии 8 класс (1 DVD ) – М.: ЗАО «Образование – Медиа», ОАО «Издательство «Просвещение»,2010 год
















































