|
Проявляют интерес к изучаемой теме
Формулируют своё мнение по изучаемой теме
Осуществляют планирование учебного сотрудничества с учителем и сверстниками.
| Вступительное слово учителя.
- Ребята, добрый день! Давайте посмотрим, друг на друга и улыбнёмся. Говорят, «улыбка – это поцелуй души». Присаживайтесь на свои места. Я рада, что у вас хорошее настроение, это значит, что мы с вами сегодня очень дружно и активно поработаем. 2. Мотивация. Демонстрация слайд-шоу, в котором на фоне музыки сменяют друг друга «короткие картинки»: мартеновская печь, железный метеорит, древние китайские скульптуры из бронзы, металлопрокат, металлические музыкальные инструменты – труба, медные тарелки, саксофон, жидкий расплавленный металл, тюбики масляных красок, металлические конструкции (пролеты мостов, Эйфелева башня, литые чугунные решетки, узорная металлическая мебель), рельсы ж/д, транспорт, изумрудная зелень растений, монеты, памятники и скульптуры из металла – Рабочий и Колхозница, памятник Покорителям космоса, золотая маска фараона, Колосс Родосский, Царь-пушка, Царь-колокол; старинное и современное оружие, доспехи воинов, кровь (гемоглобин), авиация, космические корабли и спутники, роботы. (2-3 мин) Учитель: Ребята, как вы думаете, какое ключевое слово объединяет все эти слайды? Учитель: О чем пойдет речь сегодня на уроке? Учащиеся: О металлах. Учитель: Если вы внимательно осмотритесь вокруг себя, то где бы вы ни были: дома или в школе, на улице, в метро, на промышленных объектах или в транспорте – вы увидите, какое множество металлов трудится вокруг нас и для нас. «Профессий» у металлов много. Почему они так важны? Наверное, благодаря своим особенным свойствам. Сегодня на уроке повторим и обобщим все ваши знания о свойствах металлов, нахождении в природе и способах получения. (На экране тема урока, слайд 1) Постановка задач урока: (слайд 2) - повторить и обобщить материал о металлах; - расширить свои знания о металлах; совершенствовать навыки по проведению лабораторных опытов и решению расчетных задач. Учитель: Сегодня не просто урок, а урок-игра, в которой будут соревноваться три команды. (Происходит деление класса на три команды, выбор капитанов). Условия игры: команды будут соревноваться в 5 турах, право ответа есть у той команды, которая первой поднимет руку, выкрики будут наказываться штрафными баллами. |
Высказывают своё мнение
Записывают тему и вопрос в тетрадь
Коллективно- распределительная деятельность,
|
|
Решают расчетные задачи различного типа.
Определяют и формулируют цель деятельности на каждом этапе работы.
В диалоге с учителем учатся вырабатывать критерии оценки и определять степень успешности выполнения своей работы и работы всех, исходя из имеющихся критериев. Осуществляют синтез – составление целого из частей, пытаются самостоятельно достраивать недостающие компоненты Участвуют в создании способов решения проблем творческого и поискового характера Решают экспериментальные задачи различного типа. Осуществляют инициативное сотрудничество в представлении информации. Активно используют критерии оценки и самооценки | Учитель: Мы живем в 21 веке и сейчас огромное значение имеют деньги. Сегодня мы тоже будем играть на деньги, но непростые, а химические – химы. Это конвертируемая валюта и в конце урока вы сможете обменять заработанные деньги на оценки.
Конурс №1 «Конкурс капитанов». (3 хима). Слайд 3
Пока капитаны решают задачу на доске, у каждой группы есть возможность заработать дополнительные химы в свою копилку. (Приложение 1) «Конкурс №2 «Химический аукцион» - в нём участвует три игрока от группы, а остальные являются помощниками. Каждый из них получает по три таблички со знаками химических элементов. При ответах вы поднимаете табличку со знаком соответствующего металла через 10 секунд после характеристики металла, по моей команде. За правильный ответ участник получает 1 хим. Задание к конкурсу №2. Перед вами 3 металла: 1– Сu, 2 – Al, 3– Fe. Утверждения:
Этот металл краснокирпичного цвета. Сu Дешевый металл, поэтому он широко применяется в электротехнике для изготовления проводов. Al Этот металл считается самым электропроводным. Сu Этот металл встречается не только на Земле, но и в космосе, его обнаруживали в падающих метеоритах. Fe Этот металл называют «крылатым». Al Этот металл составная часть чугуна и стали. Fe Этот элемент является самым распространенным ионом плазмы – жидкой части крови. Fe Очень музыкальный металл, у него прекрасный голос. Сu Этот металл используют для восстановления металлов из их оксидов. Al Лёгкий металл серебристо-белого цвета Al Благородный металл. Сu Металл обладает магнитными свойствами. Fe Обладает ценными механическими свойствами — ковкостью и тягучестью. Сu Является слабым восстановителем. Сu По распространённости в земной коре Земли занимает 1-е место среди металлов. Al
Конкурс №3 «Химическая эстафета»; Слайд 4,5 Максимально группа может заработать 5 химов (за каждое уравнение по 1 химу). Задача каждой команды: соберите эти листы, составьте цепочку превращений из химических формул, которые написаны на листах (начинается цепочка простым веществом и заканчивается простым веществом) и решите цепочку превращений, уравнения напишите на доске. (Приложение 2)
Конкурс №4 «Экспериментальная пауза». 3 хима Слайды 6-8 От каждой команды вызывается по два ученика. Используя предложенные реактивы нужно провести химическую реакцию. (пока двое выполняют опыт, остальные пишут уравнение реакции) (Приложение 3)
И наконец 5 конкурс «Природные соединения железа» слайды 9-12 Расположите природные соединения железа, формулы, которых даны ниже, в порядке возрастания содержания в них железа. (Приложение 4) Fе3О4 - магнетит (магнитный железняк) Fе2О3 - гематит (красный железняк) FеСО3 - сидерит (шпатовый железняк) FеS2 - пирит
|
Команды выбирают капитанов, которые на доске на время решают задачу.
Коллективно- распределительная деятельность,
Каждая группа есть зарабатывают дополнительные химы в свою копилку.
По окончании конкурса №2 проверяют правильность решенных задач у доски. В порядке эстафеты составляют и выполняют схему превращений у доски.Проверяют правильность выполненного задания Двое выполняют опыт, остальные пишут уравнение реакции, проверяют правильность выполненного задания
Решают расчетные задачи. |
| Анализируют эмоциональное состояние, полученное от успешной (неуспешной) деятельности, оценивают их влияние на настроение человека.
| Слайд 14,15 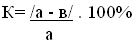 а - общее число утверждений; в - число допущенных ошибок в тесте. При К = 80-100%- оценка “5”; При К = 65-79%-оценка “4”; При К = 50-64%-оценка “3”; При К Рефлексия -Все ли вам было понятно в течение урока? -Какая часть урока показалась самой интересной? -Какая часть урока вызвала затруднение? -Какое у вас настроение после урока?
|
По результатам тестирования рассчитывают коэффициент усвоения темы.
Высказывают свое мнение по уроку. Обменивают свои химы на оценки.
|
























