
Урок по теме: «Растворы. Решение задач»
Цель: воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости грамотного отношения к своему здоровью и окружающей среде.
Кольцова Галина Алексеевна
Учитель химии МКОУ «СОШ №3»
г. Нововоронеж

Задачи:
1. Подвести обучающихся к пониманию необходимости знаний о растворах.
2.Познакомить с новым способом решения задач. Способствовать развитию умения мыслить логически и владеть химическим языком,
3. Развивать навыки наблюдения, экспериментальные навыки, решения задач, умения выделять главное и делать выводы.
4. Воспитывать умение работать самостоятельно. Показать связь изученной темы с жизнью. Развивать смекалку учащихся.
5. Создать на уроке условия для сохранения здоровья.

Растворы
Раствор — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.

Растворы в жизни человека
Растворы встречаются в нашей жизни чаще чем мы думаем. Они повсюду нас окружают.
Чай и кофе с которых начинается день большинства людей тоже растворы

Бетон, с помощью которого строятся дома в которых мы живём – это раствор цемента и воды.

Все кристаллические вещества, считающиеся чистыми, представляют собой твёрдые растворы с очень малым содержанием примесей

Вода тоже содержит различные примеси
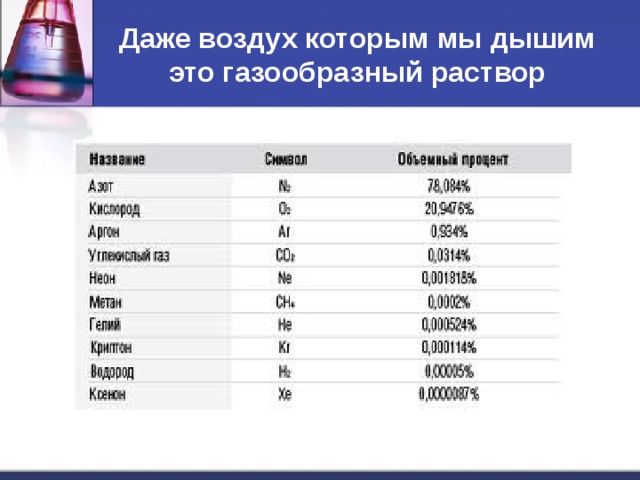
Даже воздух которым мы дышим это газообразный раствор

Химический раствор
Пример химического раствора : вода + поваренная соль

Способы выражения концентрации растворов
Концентрация — величина, характеризующая количественный состав раствора.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в процентах.
где:
— масса растворённого вещества, г (кг);
— общая масса раствора, г (кг).

Молярность (молярная объёмная концентрация)
Молярная концентрация — количество растворённого вещества в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации- С(х), которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
где:
— количество растворённого вещества, моль;
V — общий объём раствора, л.

Эксперимент
Опыт 1. К 1 мл. 10 %-ному раствору хлорида натрия прилейте 1 мл. 5% - ного раствора хлорида натрия. Что наблюдаете? Как меняется концентрация вещества в растворе при сливании двух этих растворов? Как изменится концентрация соли, если в раствор соли добавить 10 г хлорида натрия? А если добавить 50 мл воды?
Вывод:
Увеличить процентное содержание какого либо вещества можно добавив в раствор это же вещество. Уменьшить процентное содержание какого либо вещества можно добавив в раствор любое другое вещество.
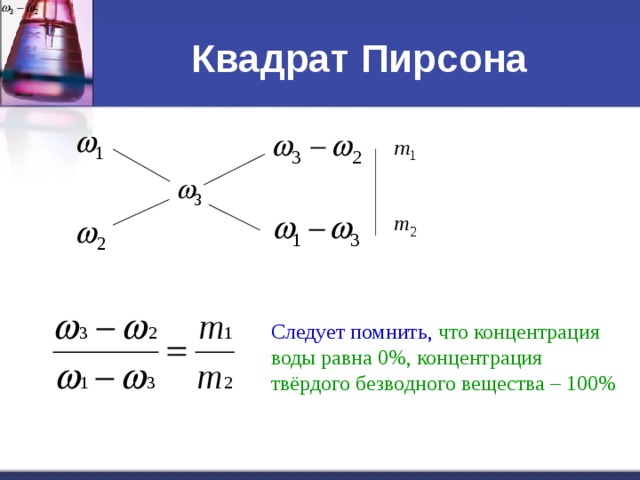
Квадрат Пирсона
Следует помнить, что концентрация воды равна 0%, концентрация твёрдого безводного вещества – 100%

Общие рекомендации к решению задач Д.Пойа
«Обдумай цель раньше, чем начать…» - люди начинают вносить предложения, обсуждать и даже бороться за дело, не поняв, какой цели они добиваются.
«С началом считается глупец, о конце думает мудрец» - если вы не уяснили конечной цели, не трудно при решении задачи сбиться с пути, а затем и вовсе забросить её.
«Мудрый меняет свои решения, а дурак никогда» - если мы терпим неудачу, приходится пробовать другие средства и другие пути.
«Подмечай главную возможность» - преимущество «знатока» в том, что он всегда начеку и лучше ориентируется в ситуации.
«Желаемое мы охотно принимаем за действительное» - наш план даёт лишь один общий контур решения. Надо убедиться, что детали соответствуют ему, поэтому мы должны внимательно рассмотреть каждую из них одну за другой.

Пример 1
Определить массы исходных растворов с массовыми долями серной кислоты 7,5 % и 60 %, если при их смешивании образовался раствор массой 350 г с массовой долей кислоты 15 %.
Решение:
60%
7,5
15%
7,5%
45
= 300г
= 50г и

Проверь себя
Пример 2. В каких массовых соотношениях надо смешать 20% и 5% - ные растворы одного вещества, чтобы получить 10% раствор?
Пример 3. Какой объём воды надо прибавить к раствору серной кислоты объёмом 100 мл с массовой долей 20 % и плотностью 1,14 г/мл, чтобы получить 5 % раствор?
Пример 4. Определите массу раствора 9%-ого столового уксуса, который получают из90 г 80 % уксусной кислоты?

Эксперимент
Опыт 1. Возьмите пробирку и поместите в неё магниевую стружку, прилейте 1-2 мл. соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Опыт 2. В две пробирки налейте 2 мл. раствора карбоната натрия. Затем в одну пробирку прилейте раствор соляной кислоты, а в другую – хлорида магния. Что наблюдаете? Напишите уравнение реакции.
Опыт 3. Возьмите пробирку и налейте в неё 1мл. «купоросной водки», затем добавьте 1-2 мл. раствора хлорида бария. Что наблюдаете? Напишите уравнение реакции.
Как найти массу раствора в этих случаях после реакции?

Задания для закрепления
1**)
Какую массу AgNO3 необходимо добавить к 100 г 5,5 М раствора HCl (ρ = 1,1 г/мл), чтобы получить раствор, в котором массовая доля соляной кислоты равна 10 %? (Ответ: 34 г AgNO3)
Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20%-ной соляной кислоты (плотность 1,1 г/мл) на 4г сульфида железа (II). (Ответ: 19,3 % FeCl2, 7,3 % HCl.)
2*)
3) Какой объём воды надо добавить к 100 г. 70% раствора уксусной кислоты, чтобы получит 9% раствор?











































