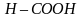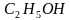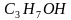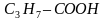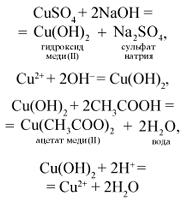Дагестанский институт повышения квалификации
педагогических кадров
Проект
По теме:
Реализация требований ФГОС при изучении темы
“Кислородсодержащие органические вещества”
Учитель химии МБОУ
СОШ №36
Ярахмедова И.А
Махачкала 2014 год.
План
1.Анотация - ………………………………………………………………….1стр
2.Введение: модернизация Российского образования .ФГОС, его назначение……………………………………………………………………..2стр
3.Основная часть…………………………………………………..…………6 стр.
3.1.Значение темы для развития мировоззрения учащихся.
Цель и задачи темы.
3.2.Планирование темы по урокам………………………………………….7 стр.
3.3. Уроки по теме. Цели, планируемые результаты, краткое содержание , контроль знаний………………………………………………………….…13 стр.
Материальные ресурсы…………………………………………………….38 стр.
3.4.Итоговая контрольная работа по теме………………………………...39 стр.
4.Рекомендации……………………………………………………………..44 стр.
5.Заключение………………………………………………………………..44 стр.
6. Список использованной литературы…………………………………...45 стр.
Аннотация к проекту
«Кислородсодержащие органические соединения»
Разработка проектной работы на тему «Кислородсодержащие органические вещества» задумана для развития знаний, выработке умений применять эти знания в дальнейшем изучении органической химии.
В ходе изучения данной темы обрабатываются навыки учащихся по составлению структурных формул кислородсодержащих органических веществ их изомеров и гомологов, умению записывать уравнения химических реакций доказывающих химические свойства, способы получения и генетическую связь между классами кислородсодержащих органических веществ.
В проекте использованы различные демонстрационные эксперименты для формирования навыков лабораторной техники, развития абстрактного мышления учащихся. Содержание уроков включают не только химический , но и исторический , биологический ,эстетический компоненты ,которые соотнесены с интересами и возрастными особенностями детей.
Уроки должны формировать бережное отношение к окружающей среде и воспитание здорового образа жизни .Для закрепления знаний учащихся используются : демонстрационный материал ( образцы химически веществ), дидактический материал (карточки с заданиями ,тесты ), ИКТ , что приводит к развитию познавательной деятельности путем сравнения, синтеза и обобщения.
Введение: модернизация Российского образования, ФГОС, его назначение.
Без преувеличения можно сказать, что главным, определяющим в деятельности всех работников образования — от вожатой до министра — на многие годы вперёд становятся новые образовательные стандарты. Они знаменуют новую эру в российском образовании... а вот внимания и, что ещё важнее, системной и систематической работы по изучению, осмыслению их, прямо скажем, не наблюдается.
— Чем вызвана необходимость принятия стандарта нового поколения?
В конце 2010 года были обнародованы результаты международного исследования PISA, проведенного в 65 странах, в том числе в России. Это международное исследование отвечает на три вопроса: каково состояние образования в стране с точки зрения международных стандартов; что изменилось в образовании за последнее десятилетие; в каком направлении следует совершенствовать образование.
Пятнадцатилетние школьники оценивались по трём направлениям: 1) техника чтения; 2) математические навыки; 3) естественнонаучные знания. Исследования были направлены на оценку способностей учащихся применять полученные знания и умения в жизненных ситуациях.
Россия заняла 45 место из 65 возможных по уровню грамотности школьников. В 2009 году Россия показала результаты близкие к полученным в 2000 году. Эксперты PISA отмечают: в России, как нигде, прослеживается тесная связь между хорошим результатом ребёнка и уровнем благополучия родителей. Чем выше материальное состояние, тем лучше результат у школьника. А в странах — лидерах исследования PI5A — Южной Корее, Финляндии, Китае, Сингапуре — самым значимым показателем является школа (маленькая, оснащенная) и высокого уровня учитель.
Результаты свидетельствуют: в России 27 % школьников не достигают порога в технике чтения; 29 % — в математике; и 22 % — в естествознании, т. е. каждый четвертый школьник не осваивает минимума знаний. А в странах Организации экономического сотрудничества и развития (ОЭСР) эти показатели соответственно составляют 19 %, 22 % и 18 %. У нас примерно в два раза меньше талантливых детей по этим направлениям, чем в странах ОЭСР. Поэтому ФГОС нового поколения с его новациями позволит совершить прорыв в образовании. Возможно, это произойдёт в следующем поколении первоклассников 2011 года, которые достигнут пятнадцатилетия в 2018 году.
В основу разработки стандарта положена целевая установка, предусматривающая переход от «догоняющей» к «опережающей» модели развития российского образования, отказ от прямого копирования западных моделей образования. При разработке стандарта был полностью учтён происходящий в условиях информационного общества процесс формирования новой дидактической модели образования, основанной на компетентностной образовательной парадигме.
Её результат — воспитание успешного поколения граждан страны, владеющих созвучными времени знаниями, навыками и компетенциями; воспитание на идеалах демократии и правового государства в соответствии с национальными и общечеловеческими ценностями.
Другой отличительной особенностью нового стандарта является переход в образовании к стратегии социального проектирования и конструирования на основе системно-деятельностного подхода и придания образовательному процессу воспитательной функции
Реализация новых стандартов на всех ступенях общего и профессионального образования требует соответствующей подготовки руководящих и педагогических кадров как в системе высшего профессионального образования, так и в системе дополнительного профессионального педагогического образования: педагоги должны овладеть компетенциями, необходимыми для реализации ФГОС. Федеральные государственные образовательные стандарты общего образования отражают понимание научно-педагогическим сообществом вызовов, возникших перед отечественной системой образования в условиях её интеграции в мировое образовательное пространство. На современном этапе информационной революции в значительной степени изменились требования к образованному человеку. Сегодня ему невозможно знать всё о достижениях в естественных и гуманитарных науках, но очень важно научиться применять свои знания в ко нкретных жизненных ситуациях. ВХХ1в.актуальным становится формирование личностной готовности и способности к непрерывному образованию, формированию компетенций, востребованных на рынке труда. В условиях повышения мобильности, развития миграционных процессов все более значимым становится воспитание российской гражданской идентичности молодых россиян, выпускников общеобразовательных учреждений.
В связи с формированием современной насыщенной информационно образовательной среды не менее важно обеспечить переход к новой образовательной парадигме системно-деятельностного обучения. Стандарты общего образования первого поколения, регламентирующие содержание образования в дидактических единицах, соответствовали классической образовательной парадигме конца ХХв. В начале ХХ1в. они перестали выполнять функцию педагогической поддержки развития образовательного пространства.
Осознание экспертным научно-педагогическим сообществом потребности в новых инструментах развития образовательного пространства России в ХХ1в. привело к разработке новых образовательных стандартов. Принципиальным отличием государственных образовательных стандартов второго поколения является усиление их ориентации на результаты образования как системообразующий компонент конструкции стандартов. В новых стандартах объектом стандартизации стало не содержание образования, ориентированное на достижение относительно частных предметных образовательных результатов, а система требований к образовательным результатам -личностным, метапредметным, предметным. Стандарт общего образования второго поколения представляет совокупность требований, обязательных при реализации основной образовательной программы основного общего образования образовательными учреждениями, имеющими государственную аккредитацию. В соответствии с новым методологическим подходом изменились структура и содержание стандартов. Основными документами, составляющими нормативный пакет ФГОС, выступают требования к результатам, структуре и условиям освоения основной образовательной программы основного общего образования.
В сочетании с документами инструктивно-методического и рекомендательного характера они образуют систему всестороннего и разноуровневого сопровождения стандартов (нормативное, методологическое, инструментальное, технологическое, информационнометодическое).
Стандарты второго поколения адресованы широкому кругу пользователей и поэтому изложены доступным языком. За рамками содержания стандартов остались вопросы, имеющие сугубо профессиональное, прикладное значение, в том числе для руководящих и педагогических кадров ОУ. Указывая на необходимость создания системы методического сопровождения деятельности педагогов на всех этапах реализации требований ФГОС, новые образовательные стандарты ставят перед системой ИПК задачу обеспечения адекватности системы непрерывного педагогического образования происходящим изменениям в системе образования в целом.
3.Основная часть.
1.Значение темы для развития мировоззрения учащихся.
 Тема « Кислородсодержащие органические вещества» является одним из самых важных разделов органической химии .При изучении этой темы формируются базовые знания о функциональных группах: гидроксильная, карбонильная, карбоксильная ,классифиацию веществ по функциональным группам выявляется генетическая связь между классами органических веществ. У учащихся формируется целостное предстваление о кислород содержащих органиеских соединениях ,их биологической роли, умение граммотно оценивать безопасность химических веществ , правильно применять их бытовой сфере и в повседневной жизни, развивать научное мировоззрение учащихся при усвоение мировоззренчиских идей: единство живой и не живой природы , взависимость свойст вещест от состава и строения, нахождения и роли в природе.
Тема « Кислородсодержащие органические вещества» является одним из самых важных разделов органической химии .При изучении этой темы формируются базовые знания о функциональных группах: гидроксильная, карбонильная, карбоксильная ,классифиацию веществ по функциональным группам выявляется генетическая связь между классами органических веществ. У учащихся формируется целостное предстваление о кислород содержащих органиеских соединениях ,их биологической роли, умение граммотно оценивать безопасность химических веществ , правильно применять их бытовой сфере и в повседневной жизни, развивать научное мировоззрение учащихся при усвоение мировоззренчиских идей: единство живой и не живой природы , взависимость свойст вещест от состава и строения, нахождения и роли в природе.
2.Цели и задачи .
Способствовать формированию знаний о кислородсодержащих органических соединениях .
Научить составлять формулы изомеров и гамологов.
Научить записывать уравнения химических реакций
Развить позновательный интерес и интелетуальные способности самостоятельного приобретения знаний.
Научить проводить эксперименты, обрабатывать, анализировать полученную в результате химического эксперимента информацию.
Обобщить и систематизировать знания учащихся об основных классах кислородсодержащих органических соединениях .
Развивать у учащихся потребности в здоровом образе жизни.
Урок по теме:
«Карбоновые кислоты»
Цель урока- создать условие для формирования знаний о карбоновых кислотах их свойствах: физических и химических в сравнение со спиртами.
Задачи:
Образовательные: рассмотреть общие свойства карбоновых кислот в сравнении со свойствами минеральных кислот. Сравнить физические свойства спиртов и карбоновых кислот.
Развивающие: развивать интеллектуальные умения – выделять главное, анализировать, сравнивать, делать выводы, использовать ранее накопленные знания по химии в контексте нового материала, расширять научную лексику в результате введения в активный словарь новых терминов, продолжать формирование умений оформлять результаты своей работы и делать обобщения на основании полученных результатов.
Воспитательные: воспитывать коммуникативные навыки, формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую мотивацию к изучению химии на основании положительного эмоционального восприятия предмета.
Планируемые результаты обучения.
Предметные: учащиеся должны знать строение функциональной группы карбоновых кислот; общие физические, химические свойства карбоновых кислот.
Метапредметные: уметь объяснять взаимное влияние атомов в функциональной группе, образование водородной связи между молекулами карбоновых кислот; кислотные свойства карбоновых кислот, уметь обобщать полученные результаты и делать выводы .
Личностные: понимать коммуникативные навыки, формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую мотивацию к изучению химии на основании положительного эмоционального восприятия предмета.
Термины: карбоксильная группа ,спиртовая группа, водородная связь, карбоновые кислоты, сложные эфиры, реакция этерификации .
Лабораторное оборудование и реактивы: пробирки; растворы соляной и уксусной кислот, раствор сульфата меди(II), порошок оксида магния, лакмус, растворы гидроксида натрия, карбоната натрия.
Таблицы и дидактические материалы к уроку: «Физические свойства некоторых предельных одноатомных спиртов и предельных одноосновных карбоновых кислот», «Водородная связь между молекулами спиртов и карбоновых кислот».
Компакт-диск «Химия в школе. Сложные химические соединения в повседневной жизни». (Серия «Электронные уроки и тесты».) М.: Новый диск, 2005.
Тип урока: исследовательный урок в виде КВН .
Девиз урока-
Ум заключается не только в знаниях,
но и в умении применять знания на деле…
Аристотель
ХОД УРОКА
Актуализация знаний и умений учащихся .
Урок начинается с игры «Черный ящик», в ходе которой формулируются тема, цели и задачи урока.
Учитель. Вам уже известны общие физические свойства карбоновых кислот, знаете вы и строение функциональной группы, номенклатуру этих кислородосодержащих органических соединений. А хорошо ли вам знакомы отдельные представители этого класса соединений?
Задание «Черный ящик».
1-е в е щ е с т в о.
У меня в черном ящике находится удивительное, но хорошо вам знакомое вещество. Название этого вещества древними греками отождествлялось с самим представлением о кислом. Нам оно хорошо известно в жидком агрегатном состоянии, но при охлаждении ниже 17 °С превращается в бесцветные кристаллы, похожие на лед
. 
О т в е т. Уксусная кислота (в ящике
находится бутылка с уксусом).
2-е в е щ е с т в о.
В черном ящике находится вещество, которым богаты плоды цитрусовых. В мякоти апельсина его около 2 %, в лимоне – 6 %. Было впервые выделено в 1784 г. К.Шееле.
Плоды, богатые лимонной кислотой…

О т в е т. Лимонная кислота (в черный ящик можно поместить
апельсины, лимоны, пакетики с лимонной кислотой).
3-е в е щ е с т в о.
Впервые было получено алхимиком Агриколой, который наблюдал при прокаливании янтаря похожий на соль белый налет этого вещества; используется в медицине.
О т в е т. Янтарная кислота (таблетки янтарной кислоты
и табличка с формулой НООС–СН2–СН2–СООН).
Учитель. Янтарная кислота – настоящий подарок для нас. Это естественное вещество, которое присутствует в организме, вырабатывается им. При приеме внутрь не вызывает привыкания и особых побочных эффектов, укрепляет иммунитет, усиливает клеточное дыхание, способствует усвоению кислорода клетками.
2. Беседа по итогам мини-разминки.
• К какому классу кислородосодержащих органических соединений относятся эти вещества?
• Как называется функциональная группа, содержащаяся в этих соединениях?
• Какие свойства веществ помогли нам их быстро определить?
• Как вы думаете, какие свойства продемонстрированных органических соединений мы еще не рассматривали?
В ходе обсуждения ответов формулируются новые вопросы:
• Какая связь существует между свойствами карбоновых кислот и их строением?
• Сходны ли по свойствам органические кислоты и минеральные, и если сходны, в чем причина этого?
3. Работа в малых группах.
Затем определяются направления и способы дальнейшей работы, заранее оговариваются формы представления результатов, критерии их оценивания. Работа класса организуется в малых группах, каждая из которых выполняет собственное исследование.
Г р у п п а 1. «Исследование строения предельных карбоновых кислот, сравнение физических свойств предельных карбоновых кислот и предельных одноатомных спиртов».
На основе молекулярной формулы уксусной кислоты и общей формулы карбоновых кислот, учитывая положения теории строения органических соединений, группе необходимо рассмотреть электронное строение уксусной кислоты. Указать взаимное влияние атомов в функциональной группе карбоновых кислот; провести сравнение температур кипения и плавления спиртов и кислот (табл. 1).
Таблица 1
| Спирты | Карбоновые кислоты |
| Формула спирта | Температура, °С | Формула кислоты | Температура, °С |
| плавления | кипения | плавления | кипения |
| 
| –98 | 65 | 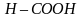
| 8,3 | 100,8 |
| 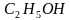
| –117 | 78 | 
| 16,8 | 118,1 |
| 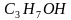
| –127 | 97 | 
| –20,8 | 141,1 |
| 
| –80 | 118 | 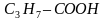
| –5 | 163,5 |
Шаги решения исследовательской задачи: определение валентности всех химических элементов в молекулярной формуле уксусной кислоты; выделение функциональной группы; на основе положения химических элементов в таблице Д.И.Менделеева проведение анализа смещения электронной плотности в молекуле.
Задание для группы 1.
Прочитайте соответствующий раздел учебника. Рассмотрите представленную таблицу (см. табл. 1) и справочную информацию. Составьте структурную и электронную формулы уксусной кислоты, объясните смещение электронной плотности в молекуле органической кислоты, сравните физические свойства предельных одноатомных спиртов и предельных одноосновных карбоновых кислот. Составьте схему образования водородной связи между двумя молекулами уксусной кислоты.
Низшие члены гомологического ряда одноосновных карбоновых кислот являются жидкостями. Муравьиная, уксусная и пропионовая кислоты обладают резким запахом, смешиваются с водой в любых соотношениях. Последующие кислоты, начиная с масляной, имеют неприятный запах и ограниченно растворяются в воде. Высшие кислоты – твердые вещества, нерастворимые в воде.
Результатом работы являются схемы: смещение электронной плотности в молекуле уксусной кислоты; образование водородных связей между молекулами.
Г р у п п а 2. «Исследование взаимодействия уксусной и соляной кислот с металлами и действие на индикатор».
Группе необходимо на основе знаний о химических свойствах минеральных кислот (на примере соляной кислоты) выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту. Учащиеся самостоятельно проводят химический эксперимент и сравнивают взаимодействие соляной и уксусной кислот с лакмусом и порошком магния, соблюдая правила техники безопасности. В ходе выполнения лабораторного опыта учащиеся должны подтвердить или опровергнуть предположение о сходстве общих химических свойств минеральных и органических кислот.
Задание для группы 2.
Лабораторная работа.
Свойства уксусной кислоты в сравнении со свойствами соляной кислоты
О п ы т 1. В две пробирки налейте по 1–2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами и минеральными кислотами). В 1-ю пробирку внесите 1–2 капли лакмуса (отметьте цвет индикатора). Во 2-ю пробирку добавьте немного порошка магния.
О п ы т 2. В две пробирки налейте по 1–2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами). В одну пробирку добавьте 1–2 капли лакмуса (отметьте цвет индикатора). В другую добавьте немного порошка магния.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций.
Результатом работы являются наблюдения, оформленные в виде таблицы (табл. 2), записи уравнений реакций, вывод, а также названия полученных веществ.
| Вещество | № опыта | Действие | Наблюдение | Уравнение реакции |
| Уксусная кислота | 1 | Взаимодействие с лакмусом | Лакмус окрасился в красный цвет | – |
| Взаимодействие с магнием | Выделение газа | 
2Н+ + Mg = Mg2+ + Н2 |
| Соляная кислота | 2 | Взаимодействие с лакмусом | Лакмус окрасился в красный цвет | _ |
| Взаимодействие с магнием | Выделение газа | 
2Н+ + Mg = Mg2+ + Н2 |
Вывод. Уксусная и соляная кислоты одинаково взаимодействуют с активным металлом магнием. Магний вытесняет водород из растворов кислот. Лакмус в обеих кислотах окрашивается в красный цвет.
Г р у п п а 3. «Исследование взаимодействия уксусной и соляной кислот с оксидами металлов и основаниями».
Группе необходимо на основе знаний о химических свойствах минеральных кислот (на примере соляной кислоты) выдвинуть гипотезу о возможности переноса этих свойств на уксусную кислоту. Учащиеся самостоятельно проводят химический эксперимент и сравнивают взаимодействие соляной и уксусной кислот с раствором щелочи и оксидом магния.
Задание для группы 3.
Лабораторная работа.
Свойства уксусной кислоты в сравнении со свойствами соляной кислоты
О п ы т 1. В две пробирки налейте по 1–2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами). В 1-ю пробирку добавьте немного порошка оксида магния. Во 2-ю пробирку внесите 1–2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи (гидроксида натрия).
О п ы т 2. В две пробирки налейте 1–2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами). В 1-ю пробирку добавьте немного порошка оксида магния. Во 2-ю пробирку внесите 1–2 капли лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи.
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы (табл. 3).
Таблица 3

Результатом работы являются уравнения химических реакций, названия полученных веществ и вывод.
Вывод. Уксусная и соляная кислоты одинаково реагируют с оксидами металлов и щелочами, образуя соответствующие соли и воду.
Г р у п п а 4. «Исследование взаимодействия уксусной и соляной кислот с солями и нерастворимыми основаниями».
Группе необходимо выдвинуть предположение о сходстве химических свойств минеральных и органических кислот. Учащиеся самостоятельно проводят химический эксперимент, в котором сравнивают взаимодействие этих кислот с карбонатом натрия и гидроксидом меди(II).
Задание для группы 4.
Лабораторная работа.
Свойства уксусной кислоты в сравнении со свойствами соляной кислоты
О п ы т 1. Налейте в 1-ю пробирку 2–3 мл раствора сульфата меди(II) и прибавьте 1–2 мл раствора гидроксида натрия (отметьте, что наблюдаете), затем налейте немного уксусной кислоты. Во 2-ю пробирку налейте 1–2 мл раствора уксусной кислоты, затем добавьте раствор карбоната натрия.
О п ы т 2. Налейте в 1-ю пробирку 2–3 мл раствора сульфата меди(II) и прибавьте 1–2 мл раствора гидроксида натрия (отметьте, что наблюдаете), затем налейте раствор соляной кислоты. Во 2-ю пробирку налейте 1–2 мл раствора соляной кислоты, затем добавьте раствор карбоната натрия.
Отметьте, какие изменения произошли в опытах. Сделайте соответствующий вывод. Составьте полные и сокращенные ионные уравнения проведенных реакций. Наблюдения оформите в виде таблицы (табл. 4).
| Вещество | № опыта | Действие | Наблюдение | Уравнения реакций |
| Уксусная кислота | 1 | Взаимодействие с нерастворимым основанием – гидроксидом меди(II) | При смешивании растворов сульфата меди(II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора уксусной кислоты | 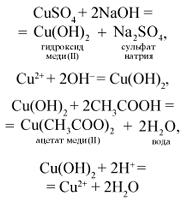
|
| Взаимодействие с раствором карбоната натрия | Выделение газа
| 
|
| Соляная кислота | 2 | Взаимодействие с нерастворимым основанием – гидроксидом меди(II) |
При смешивании растворов сульфата меди(II) и гидроксида натрия выпал осадок синего цвета, который растворяется при добавлении раствора соляной кислоты
| 
|
| Взаимодействие с раствором карбоната натрия |
Выделение газа
| 
|
Результатом исследования являются записи уравнений химических реакций, названий полученных веществ и вывод.
Вывод. Уксусная и соляная кислоты проявляют общие химические свойства, реагируют с нерастворимыми основаниями и солями.
4. Представление и оценка результатов.
После завершения исследования группы представляют результаты своей работы, которые оцениваются по следующим критериям:
1) Умение школьников кратко обобщить и записать итог выполненной работы в виде химических формул, уравнений, выводов.
2) Умение учащихся конкретно, полно, развернуто и научно объяснить полученные результаты исследования.
3) Использование средств наглядности (моделей, таблиц, схем, эксперимента) для обоснования своих теоретических выводов.
4) Умение учащихся правильно говорить на «химическом языке».
5) Участие (активность) каждого ученика в работе группы.
6) Умение учащихся анализировать, сравнивать, логически мыслить и делать выводы.
5. Закрепление знаний.
В качестве закрепления знаний и обобщения полученных результатов учащимся предлагается ответить на вопросы мини-теста «Пятерочка» (если учащиеся отвечают правильно, то в таблице ответов (табл. 5) появляется цифра пять).

Тест
Отметьте правильные ответы (их может быть несколько) в таблице.
1. Раствор уксусной кислоты реагирует с веществами:
а) NН3; б) FeO; в) Na2CO3; г) ZnO; д) CO.
2. Предельные одноосновные карбоновые кислоты имеют общую формулу:
а) СnН2nO; б) СnН2nO2; в) СnН2n+2O;
г) СnН2nO3; д) СnН2n–2O2.
3. Следующие признаки верно отражают физические свойства уксусной кислоты:
а) газообразное вещество;
б) имеет характерный запах;
в) хорошо растворяется в воде;
г) при комнатной температуре бесцветная жидкость;
д) плохо растворяется в воде.
4. Соли уксусной кислоты называются:
а) формиаты; б) цитраты; в) пропионаты;
г) ацетаты; д) оксалаты.
5. При взаимодействии уксусной кислоты с карбонатом натрия образуются вещества:
а) Н2СО3; б) СО2; в) Н2О;
г) СН3СООNa; д) NaОН.
6. Итоги урока:
7.Домашнее задание
:§20 упр 14,15,18.
Тема урока:
«СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ»
Цели урока.
Продолжить формирование системы знаний о классах органических соединений и генетической связи между ними; способствовать закреплению понимания взаимосвязи применения, свойств и химического строения веществ.
Задачи урока:
Образовательные:
1.Закрепить знания о сложных эфирах, их номенклатуре, реакции этерификации.
2. Дать понятия о физических и химических свойствах сложных эфиров, механизме реакции этерификации.
Развивающие:
Развить понятие о водородной связи, взаимном влиянии атомов, воздействии этих явлений на свойства веществ.
Воспитательные:
Способствовать развитию эрудиции, логического и ассоциативного мышления учащихся.
Планируемые результаты:
Предметные: знать номенклатуру сложных эфиров, физические и химические свойства, механизм реакции этерификации.
Метапредметные: уметь связывать, свойства сложных эфиров с взаимным влиянием атомов в молекулах сложных веществ .
Личностные: понимать взаимосвязь кислородсодержащих органических соединений и роль сложных эфиров и жиров в жизни деятельности человека.
Термины :
Сложные эфиры, реакция этерификации, жиры, реакция омыления , реакция гидолиза.
Оборудование:
образцы органических веществ: спирты, карбоновых кислот,жиры растительные и животные,ИКТ.
Методы и приемы: словесные, наглядные, практические – в логической взаимосвязи.
Тип урока: лекция-шоу.
ХОД УРОКА
Организационный момент.
Тема урока «Сложные эфиры. Жиры». Форма проведения урока – лекция-шоу. Вам, конечно, знакомо английское слово «show». Оно означает «показывать». Заимствована лекция-шоу из интенсивных методик, применяемых в обучении бизнесменов. Лекция-шоу предполагает донесение основной информации до учащихся через пиктограммы – логические рисунки, где в символах и условных знаках «зашифровано» содержание изучаемого. Чтобы расшифровать пиктограмму, нужно понять ее внутреннюю логику, соединив усилия восприятия, воображения и мышления, активно работая над изучаемым материалом, в результате чего содержание усваивается прочно. Как девиз лекциям-шоу очень соответствуют слова А.Эйнштейна: «Самое лучшее, что может быть, – это видеть и понимать». Внимательно смотреть, стараться понять и применять к учебной ситуации знания, которыми вы владеете, – все это требуется от вас сейчас на уроке.
Подготовка к изучению нового материала
Сначала приведем в активное состояние имеющиеся у вас знания. На доске даны названия веществ: калий, медь, оксид магния, оксид углерода(IV), гидроксид натрия, карбонат натрия, серная кислота, этанол, этановая кислота, этаналь, хлор, хлороводород.
С какими из перечисленных веществ вступит в реакцию:
а) этиловый спирт (шесть реакций);
б) уксусная кислота (семь реакций)?
Желающие учащиеся записывают на доске по два уравнения реакций и комментируют, какие свойства отражают эти уравнения, какой тип реакции и как называются продукты.
Вывод: спирты и карбоновые кислоты взаимодействуют между собой с образованием сложных эфиров.
Изучение нового материала
(последовательная демонстрация
и комментирование пиктограмм)
Пиктограмма 1 отражает то, что реакция карбоновой кислоты со спиртом – это реакция замещения, но имеет собственное название: реакция этерификации (от греч. – эфир). А какое значение вкладывали в слово «эфир» в древности? – Воздух.

Эфирами были названы рассматриваемые вещества в эпоху алхимии, когда названия давались не случайно, а в соответствии с ярко выраженными их свойствами. Самым «выдающимся» свойством эфиров является летучесть, проявляющая себя в наличии запаха.
Назовите эфиры, формулы которых приведены на пиктограмме 1. Обратите внимание на свойственный эфирам запах: этилбутирату – ананаса, бутилбутирату – персика, пентилформиату – вишни, изопентилацетату – груши, этилбензоату – жасмина, изоамиловому эфиру изовалериановой кислоты – яблока.
С какой особенностью строения химик свяжет наличие у вещества выраженного запаха? С отсутствием между молекулами водородных связей.
А почему между молекулами сложных эфиров водородные связи не образуются? Нет связи О–Н, в которой атом водорода соединен с электроотрицательным атомом.
Итак, водородных связей между молекулами нет, а температуры кипения сложных эфиров достаточно высокие. Как химик объяснит эту особенность сложных эфиров? Достаточно длинные молекулярные цепи – межмолекулярное притяжение значительно.
Какие еще физические свойства химик может предсказать для сложных эфиров? Они хорошо растворяются в воде за счет образования водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода молекул эфира. Составьте схему водородной связи на любом примере.
Обратим еще раз внимание на реакцию этерификации. При каких условиях она протекает?
Необходимы повышенная температура и наличие концентрированной серной кислоты. Какова роль серной кислоты? Это катализатор для ускорения реакции и водопоглощающее средство для смещения химического равновесия в сторону образования продуктов реакции.
Составьте уравнения реакций образования эфиров, указанных на пиктограмме 1. При составлении уравнений реакций этерификации обратите внимание на то, что кислоты теряют гидроксигруппу, а спирты – атом водорода. Почему реакция протекает именно так, объясняется ее механизмом. Для понимания этого механизма вспомним взаимное влияние атомов в молекулах карбоновых кислот (пояснение заготовленной на доске схеме).
Пиктограмма 2 отражает то, что, образно говоря, в молекулах карбоновых кислот доминирует
-связь, стабилизированная p--сопряжением с одной из неподеленных электронных пар гидроксильного атома кислорода и утратившая вследствие такой стабилизации способность к самым характерным для p-связи реакциям – реакциям присоединения. Единственное исключение – реакция со спиртами, этерификация, механизм которой, как мы сейчас увидим, включает присоединение за счет разрыва -связи.
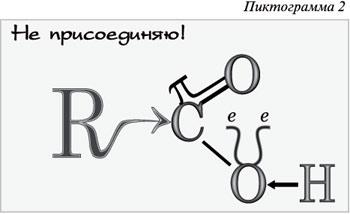
Пиктограмма 3 на образном языке демонстрирует, что пристрастие к спиртному разрушительно даже для химических связей, а для человека – тем более.
Методом меченых атомов доказано, что молекулы карбоновых кислот в реакции этерификации, которая обычно проводится в присутствии сильных минеральных кислот, отщепляют гидроксигруппу, а молекулы спиртов – атом водорода:

Важнейшее свойство сложных эфиров – гидролиз. Что такое гидролиз? Разложение вещества водой (от греч. – вода и – разложение). Гидролиз сложных эфиров – реакция, обратная этерификации. В формуле сложного эфира «кислотная» часть включает карбонильную группу, а «спиртовая» связана с «мостиковым» атомом кислорода. Водород из молекулы воды соединяется со «спиртовой» частью, а гидроксигруппа – с «кислотной» частью.
Как вы считаете, чем будут отличаться продукты реакции, если гидролиз проводится не водой, а водным раствором щелочи? (Образуется не карбоновая кислота, а ее соль, и реакция необратима.)
Составьте в тетрадях уравнения гидролиза:
пентилформиата – водой,
этилбутирата – водой,
пропилформиата – гидроксидом калия,
метилбутирата – гидроксидом лития,
изопропилацетата – гидроксидом натрия.
Прежде чем прокомментировать следующую пиктограмму, составьте уравнения реакций:
этилен + вода,
тримеризация ацетилена,
хлорбензол + гидроксид калия (t, p),
оксид углерода(II) + расплав гидроксида калия,
гидрирование угля,
гидрирование ацетилена,
спиртовое брожение глюкозы.
Проверьте составленные уравнения, сопоставляя их с написанными на доске.
Пиктограмма 4 имеет отношение к реакциям, с которыми мы давно знакомы, многократно составляли их уравнения в «генетических цепочках» и задачах. Объединяет эти реакции то, что впервые их осуществил французский химик Пьер Эжен Марселен Бертло – «король органического синтеза», как называли его современники и называют до сих пор историки химии. Он был не только великим химиком, но и великим человеком – умным, с умелыми руками и горячим сердцем.

На пиктограмме 4 – портрет Бертло в королевской короне, рядом прибор, в котором проводится большинство органических синтезов, в том числе синтез сложных эфиров. Прибор состоит из круглодонной колбы (для равномерного подогрева) с боковым отводом (это колба Вюрца, в ней протекает синтез), водяного холодильника Либиха, где конденсируются продукты реакции, и аллонжа, направляющего конденсат в колбу-приемник. Великому химику Бертло был дан еще редкий дар – дар большой любви. Бертло очень любил свою жену, испытывал потребность видеть ее постоянно. В его лаборатории была отгорожена стеклом кабинка, где мадам Бертло читала, вязала, пока ее муж занимался синтезами. Он всегда мог подойти к ней, поговорить, подержать за руку, и это общение вдохновляло «короля органического синтеза» на новые подвиги во благо науки.
Судьба супругов Бертло соответствует словам Александра Грина: «Они жили счастливо и умерли в один день». Действительно, Бертло не смог пережить утраты жены: она умерла утром, он – вечером. Похоронили их в одной могиле в соборе Парижской богоматери, где хоронят самых выдающихся граждан Франции.
Одним из величайших достижений химика Бертло был синтез жиров – веществ, характерных для живых организмов, т.е. органических веществ в прямом смысле этого слова. Синтезировав жиры, Бертло нанес сокрушительный удар по теории витализма – божественного происхождения органических веществ.
Пиктограмма 5 отражает то, что в работах по синтезу жиров Бертло использовал результаты аналитической деятельности своего современника, французского химика-органика Мишеля Эжена Шевреля, который изучил состав многих жиров и сделал вывод, что жиры – это сложные эфиры трехатомного спирта глицерина и карбоновых кислот, чаще всего стеариновой С17Н35СООН, пальмитиновой С15Н31СООН, масляной С3Н7СООН, олеиновой С17Н33СООН, линолевой С17Н31СООН и линоленовой С17Н29СООН. Последние три кислоты являются непредельными.
Как мы понимаем термин «непредельность»? Как практически доказать, что молекулы непредельных кислот содержат -связи?
Кислоты, входящие в состав жиров, называются «жирными кислотами». Насыщенные кислоты образуют твердые жиры, обычно они животного происхождения (исключение – кокосовое масло). Непредельные кислоты образуют жидкие жиры, они обычно растительного происхождения (исключение – рыбий жир).

Составьте в тетрадях формулы: триолеата глицерина, трипальмитата глицерина, тристеарата глицерина.
Как все сложные эфиры, жиры подвергаются водному и щелочному гидролизу. Щелочной гидролиз сложных эфиров называется омылением.
Составьте в тетрадях уравнения омыления:
тристеарата глицерина – гидроксидом натрия,
трипальмитата глицерина – гидроксидом калия.
Эти реакции используются для получения глицерина и мыла: твердого С17Н35СООNa и жидкого С15Н31СООК.
Жидкие жиры подвергаются гидрированию, например триолетат глицерина переходит в тристеарат глицерина (составить уравнение реакции). Условия гидрирования жидких жиров общие для реакций гидрирования (t, p, кат. Ni). Составленное уравнение реакции отражает химизм производства маргарина из растительного масла.
Пиктограмма 6 содержит информацию о значении сложных эфиров и жиров. Сложные эфиры используются как растворители, ароматизирующие добавки в парфюмерной, фармацевтической и пищевой отраслях промышленности. Жиры – основной источник энергии в живых организмах. При расщеплении 1 г жира освобождается существенно больше энергии, чем в случае белков и углеводов. Жировые прослойки выполняют структурные и защитные функции (жировые капсулы сердца, печени, почек), теплорегулирующую функцию (у животных – обитателей Севера и Антарктиды очень развита жировая подкожная прослойка). Жиры являются источником эндогенной воды (горб верблюда), выполняют гормональные функции, например жировую природу имеют половые гормоны. Витамины одного из классов называются «жирорастворимые», и жиры пищи способствуют усвоению этих витаминов (к ним относятся, например, витамины А и D). Как уже отмечалось, жиры используются для производства мыла и глицерина.
Подведение итогов урока.
Оценить наиболее активных учащихся, задать вопрос: «Понравилась ли вам такая форма проведения урока?»
Домашнее задание:§ 21 упр 8,9,10.
Материальные ресурсы
ИКТ, образцы химических веществ: спирты, альдегиды, карбоновые кислоты, сложные эфиры, жиры: растительные и животные жиры, пробирки, спиртовки, держатели, спички, карточки с тестовыми заданиями и инструктаж по эксперементам.
Контрольная работа по теме:
«Кислородосодержащие органические соединения»
Вариант 1
А 1. Вещество соответствующее общей формуле Сc(H2O)m относится к классу
а) альдегидов, в) спиртов
б) углеводов, г) карбоновых кислот
А 2. Вещество, являющееся изомером пропаналя
а) пропанон, в) пропановая кислота
б) пропанол, г) метилацетат
А 3. Метанол взаимодействует с веществом
а) вода, в) бромоводород,
б) гидроксид натрия, г) оксид кальция.
А 4. Гидроксид натрия взаимодействует с
а) этанола б) глицерина в) фенола г) метанола
А 5. Реакция «серебряного зеркала» характерна для вещества
а) уксусная кислота, в) этанол,
б) метилформиат, г) метаналя.
А 6. В схеме превращений C2H2 → x → CH3COOH, веществом х является
а) этанол в) хлорэтан,
б) этаналь г) 1,2 дихлорэтан.
А 7. Формула реактива для распознания многоатомных спиртов
а) Cu(OH)2, в) СuO,
б) Ag2O (аммиач. р-р), г) р-р КMnO4
А 8. При действии этанола на пропановую кислоту происходит реакция:
а) окисления, в) нейтрализации,
б) присоединения г) этерификации.
А 9. Верны ли следующие суждения о жирах:
А. Глицерин входит в состав всех природных жиров.
Б. Жиры, в состав которых входят остатки низших карбоновых кислот, в
природе не встречаются.
а) верно только А, в) верны оба суждения
б) верно только Б, г) оба суждения не верны
А 10. Масса спирта, полученного при каталитическом гидрировании 55 г
этаналя
а) 55.6 г б) 115 г в) 57,5 г г) 67.3 г
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) рибоза 1) альдегиды
Б) 3-метилбутаналь 2) карбоновые кислоты
В) метилэтилат 3) углеводы
Г) глицерин 4) простые эфиры
5) многоатомные спирты
Б 2. С какими из перечисленных веществ будет взаимодействовать уксусная кислота:
а) оксид магния,
б) оксид углерода (ΙV),
в) карбонат магния,
г) серебро,
д) бромоводород,
е) гидроксид меди (ΙΙ)
Б 3. В отличие от глюкозы, сахароза
а) является дисахаридом,
б) реагирует с аммиачным раствором оксида серебра,
в) подвергается гидролизу
г) реагирует с гидроксидом меди (ΙΙ)
Б 4. Вычислите массу металлического серебра, полученного при окислении
600 г 40% раствора метаналя аммиачным раствором оксида серебра
С 1. Составьте уравнения реакций по приведено схеме и укажите условия их
осуществления.
Крахмал → глюкоза → этанол → этилен → 1,2 дихлорэтан
С 2. Какую массу 50% раствора этанола нужно взять для получения 120 г этилбутаната?
Контрольная работа по теме:
«Кислородосодержащие органические соединения»
Вариант 2
А 1. Вещество соответствующее общей формуле RCOOH относится к классу
а) альдегидов, в) спиртов
б) углеводов, г) карбоновых кислот
А 2. Вещество, являющееся изомером пропанола-1
а) пропанон, в) пропановая кислота
б) пропаналь, г) пропанол-2
А 3. Между собой могут взаимодействовать:
а) глицерин и сульфат меди (ΙΙ), в) фенол и гидроксид меди (ΙΙ),
б) фенол и азотная кислота г) метанол и углекислый газ.
А 4. Раствор ярко-синего цвета образуется при взаимодействии гидроксида
меди (ΙΙ) с раствором:
а) глицерина, б) этанола, в) фенола г) бутанола
А 5. При гидрировании этаналя образуется:
а) ацетилен, б) этанол, в) этиленгликоль, г) уксусная кислота
А 6. В схеме превращений C2H5 Сl → x → CH3COH, веществом х является
а) этанол б) этаналь в) хлорэтан, г) 1,2 дихлорэтан.
А 7. С каким веществом при нагревании голубой осадок гидроксида меди (ΙΙ)
переходит в осадок оранжевого цвета
а) уксусной кислотой, в) этанолом,
б) метилформиатом, г) метаналем.
А 8. Формальдегид в присутствии катализатора реагирует с фенолом по типу
реакции:
а) полимеризации, в) изомеризации,
б) поликонденсации, г) этерификации.
А 9. Верны ли следующие суждения о химических свойствах глюкозы
А. Химические свойства глюкозы обусловлены наличием
функциональных групп.
Б. Глюкоза не вступает в реакцию с гидроксидом меди (ΙΙ)
а) верно только А, в) верны оба суждения
б) верно только Б, г) оба суждения не верны
А 10. Масса этанола, полученного при омылении 39,6 г этилацетата:
а) 41,4 г б) 21,1 г в) 20,7 г г) 42,2 г
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) 2-метилпропановая кислота 1) одноатомные спирты
Б) глюкоза 2) многоатомные спирты
В) этиленгликоль 3) углеводы
Г) этилформиат 4) карбоновые кислоты
5) сложные эфиры
Б 2. Метаналь вступает во взаимодействие
а) с хлороводородом,
б) с водородом,
в) с гидроксидом меди (ΙΙ),
г) с оксидом меди (ΙΙ),
д) с кислородом,
е) с алюминием
Б 3. В отличие от твёрдых, жидкие жиры:
а) в своём составе имеют остатки непредельных кислот,
б) обладают более низкими температурами плавления,
в) гидролизуются при взаимодействии с водой,
г) образуются из глицерина и предельных карбоновых кислот
д) имеют в основном животное происхождение.
Б 4. Рассчитайте массу кислоты, полученной при нагревании 55 г 40% раствора
пропаналя с избытком гидроксида меди (ΙΙ).
С 1. Составьте уравнения реакций по приведено схеме и укажите условия их
осуществления.
Этан → хлорэтан → этанол → оксид углерода (ΙV) → глюкоза
С 2. Вычислите массу 60% раствора уксусной кислоты, затраченной на нейтрализацию 30 г гидроксида натрия.
Рекомендации
При использовании данного проекта, учителям химии можно изменит ход урока, и методы изучения материла
Тема «Кислородсодержащие органические соединения» является важной при освоении школьного курса органической химии и включена в кодификатор ЕГЭ. Обратить особое внимание на хим. свойства кислородсодержащих веществ связанные с функциональными группами и взаимным влиянием .
При определении домашнего задания учитывать уровень знаний учащихся, использовать дифференцированный подход.
Уроки можно проводить с использованием ИКТ и арт-технологий , в виде игры, лекции и семинаров.
Для достижения учащимся планированных результатов, опыта разнообразной деятельности, познания и самопознания, при подготовке к уроку, дать возможность учащимся творчески подходить к подбору материала урока (сообщении учащихся, презентации)
Контроль знаний проводить используя дифференцированный подход, карточками, тестовыми заданиями и устной форме(фронтально и индивидуально)






 Тема « Кислородсодержащие органические вещества» является одним из самых важных разделов органической химии .При изучении этой темы формируются базовые знания о функциональных группах: гидроксильная, карбонильная, карбоксильная ,классифиацию веществ по функциональным группам выявляется генетическая связь между классами органических веществ. У учащихся формируется целостное предстваление о кислород содержащих органиеских соединениях ,их биологической роли, умение граммотно оценивать безопасность химических веществ , правильно применять их бытовой сфере и в повседневной жизни, развивать научное мировоззрение учащихся при усвоение мировоззренчиских идей: единство живой и не живой природы , взависимость свойст вещест от состава и строения, нахождения и роли в природе.
Тема « Кислородсодержащие органические вещества» является одним из самых важных разделов органической химии .При изучении этой темы формируются базовые знания о функциональных группах: гидроксильная, карбонильная, карбоксильная ,классифиацию веществ по функциональным группам выявляется генетическая связь между классами органических веществ. У учащихся формируется целостное предстваление о кислород содержащих органиеских соединениях ,их биологической роли, умение граммотно оценивать безопасность химических веществ , правильно применять их бытовой сфере и в повседневной жизни, развивать научное мировоззрение учащихся при усвоение мировоззренчиских идей: единство живой и не живой природы , взависимость свойст вещест от состава и строения, нахождения и роли в природе.