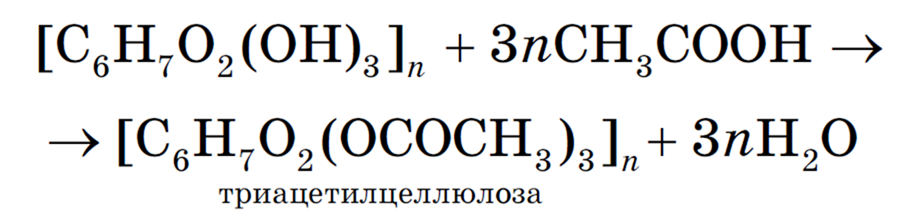МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего образования
«Югорский государственный университет» (ЮГУ)
НЕФТЯНОЙ ИНСТИТУТ
(ФИЛИАЛ) ФЕДЕРАЛЬНОГО ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ ВЫСШЕГО ОБРАЗОВАНИЯ «ЮГОРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(НефтИн (филиал) ФГБОУ ВО «ЮГУ»)
КУРС ЛЕКЦИЙ
ОУД.12 ХИМИЯ
РАЗДЕЛ КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
для обучающихся образовательных учреждений
среднего профессионального образования
Нижневартовск 2022
Курс лекций разработан по дисциплине ОУД.12 Химия для обучающихся общеобразовательных учреждений среднего профессионального образования. Рассмотрены вопросы Органической химии по разделу Кислородсодержащие органические вещества.
Учебная дисциплина ОУД.12 Химия является обязательной частью общеобразовательных учебных дисциплин.
Данная дисциплина предусматривает изучение теоретических основ общей неорганической химии и органической химии.
Содержание программы ОУД.12 Химия направлено на достижение следующих целей:
• формирование у обучающихся умения оценивать значимость химического знания для каждого человека;
• формирование у обучающихся целостного представления о мире и роли химии в создании современной естественнонаучной картины мира; умения объяснять объекты и процессы окружающей действительности: природной, социальной, культурной, технической среды, — используя для этого химические знания;
• развитие у обучающихся умений различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
• приобретение обучающимися опыта разнообразной деятельности, познания и самопознания; ключевых навыков, имеющих универсальное значение для различных видов деятельности (навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни).
Освоение содержания учебной дисциплины ОУД.12 Химия, обеспечивает достижение студентами следующих результатов:
• личностных:
−− чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами процессами;
−− готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
−− умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
• метапредметных:
−− использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
−− использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
• предметных:
−− сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
−− владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
−− владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
−− сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
−− владение правилами техники безопасности при использовании химических веществ;
−− сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА – это органические соединения, молекулы которых кроме атомов углерода и водорода, содержат атомы кислорода.
В органических соединениях, содержащих атомы других химических элементов, кроме атомов углерода и водорода, вводят понятие функциональной группы.
ФУНКЦИОНАЛЬНАЯ ГРУППА – это группа атомов, которая определяет наиболее характерные свойства вещества и его принадлежность к определенному классу соединений.
СПИРТЫ. КЛАССИФИКАЦИЯ СПИРТОВ. ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
План:
1. Определение спиртов. Классификация по различным признакам
2. Одноатомные спирты: строение, изомерия, номенклатура, свойства, получение, применение
Первый класс таких соединений – СПИРТЫ.
- ОН (гидроксогруппа или гидроксильная группа) – функциональная группа спиртов
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены функциональной гидроксильной группой.
Общая формула спиртов R(OH)n
КЛАССИФИКАЦИЯ
1) по количеству функциональных групп:
а) одноатомные (СН3-ОН метанол, С2Н5-ОН этанол и т.д.);
б) многоатомные:
- двухатомные (С2Н4(ОН)2 этандиол или этиленгликоль, С3Н6(ОН)2 пропандиол или пропиленгликоль и т.д.). Двухатомные спирты часто называют гликоли;
- трехатомные (С3Н5(ОН)3 пропантриол или глицерин, С4Н7(ОН)3 бутантриол и т.д.).
Могут быть четырехатомные и т.д.
2) по радикалу:
а) предельные (все перечисленные примеры спиртов можно взять в эту группу):
б) непредельные – радикалы содержат кратные связи (С2Н3-ОН этенол – между атомами углерода содержится двойная связь, С2Н-ОН этинол – между атомами углерода содержится тройная связь и т.д.);
в) ароматические – радикалами являются ароматические углеводороды, функциональная группа находится в боковой цепи (С6Н5-СН2-ОН фенилметанол,
С6Н5-С2Н4-ОН фенилэтанол и т.д.);
г) фенолы – радикалами являются ароматические углеводороды, но функциональная группа непосредственно связана с бензольным ядром (С6Н5-ОН фенол, С6Н4-(ОН)2 дигидроксибензол и т.д.).
Гидроксильные производные ароматических углеводородов называют ароматическими спиртами в том случае, если гидроксильная группа находится в боковой цепи, а фенолами – когда гидроксильная группа связана с углеродом ядра.
3) по положению функциональной группы (в зависимости от того, с какими атомами углерода он связан (с первичным, вторичным или третичным) различают :
а) первичные спирты – функциональная группа связана с первичным атомом углерода, т.е. находится вначале или в конце молекулы;
б) вторичные спирты - функциональная группа связана со вторичным атомом углерода, т.е. с таким атомом, у которого два соседа:
в) третичные спирты - функциональная группа связана с третичным атомом углерода, т.е. с таким атомом, у которого три соседа.
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
Изомерия спиртов обусловлена строением радикала (изомерия углеродного скелета) и положением гидроксила в молекуле.
Номенклатура
Общая формула гомологического ряда предельных одноатомных спиртов: СnH2n+1OH (СnH2n+2O).
Названия спиртов образуют, добавляя окончание – ОЛ к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу.
Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа.
Кроме того, широко распространена радикально – функциональная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением слова «спирт», например: – этиловый спирт (этанол).
Начиная с третьего представителя гомологического ряда – пропанола, у спиртов появляются изомеры: в соответствии с международной номенклатурой цифрой перед названием спирта обозначают, с каким по счету углеродным атомом связана гидроксильная группа, например: Пропиловый спирт или пропанол-1, Изопропиловый спирт или пропанол-2, гексанол-3.
Правило составления названий алканолов с разветвленной цепью по Международной единой химической номенклатуре IUPAC (ИЮПАК):
1) Найти в молекуле самую длинную прямую углеродную цепь, связанную с гидроксильной группой;
2) Пронумеровать атомы С в этой цепи так, чтобы атом С, связанный с группой – ОН, имел наименьший номер;
СН3
Например, 7 6 5 4 │ 3 2 1
С – С – С – С – С – С – С
│ │ │ │
СН3 СН3 СН3 ОН
3) Назвать алкан, соответствующий самой длинной цепи, указав положение всех заместителей: например, 2,4,4,6-Тетраметилгептан…. ;
4) Обозначить гидроксильную группу суффиксом – ОЛ;
5) Цифрой указать положение группы – ОН: 2,4,4,6-Тетраметилгептанол-1.
6) Углеродную цепь дополнить атомама водорода, согласно валентности.
Получение спиртов:
1. Гидратация алкенов. Гидратация алкенов, протекает по правилу Марковникова. При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты.
2. Гидролиз галогеноалканов. При действии водного раствора NaOH атом галогена в галогеналкане замещается группой – OH.
3. Гидрирование альдегидов и кетонов Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов и кетонов – является, таким образом, их восстановлением. В присутствии катализаторов (Ni, Pt, Pd, Co) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов
4. Специфические способы получения метанола и этанола Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:
С6Н12О→ 2С2Н5ОН + 2СО2
Физические свойства:
Рассмотрим электронное строение молекулы спирта: Н3С-ОН.
Молекулы спиртов представляют собой диполи. Они содержат полярные связи C – H, C – O, O – H. Дипольные моменты связей C → O и O ← H направлены в сторону атома кислорода, поэтому атом O имеет частичный отрицательный заряд, а атомы C и H – частичные положительные заряды. Полярность связи «О – Н» больше полярности связи «С – О» вследствие большей разности электроотрицательностей кислорода и водорода. Полярность связи «О – Н» и наличие неподеленных пар электронов на атоме кислорода приводит к образованию водородной связи между молекулами спиртов, что определяет физические свойства спиртов.
В гомологическом ряду спиртов нет газообразных веществ: низшие – жидкости, высшие – твердые вещества. Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол, пропанол неограниченно растворяются в воде; с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается; высшие спирты не растворяются в воде, т.к. водородная связь очень слабая.
Химические свойства:
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей «О – Н», «С – О», «С – Н». Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I. Реакции замещения
1) Замещение атома водорода гидроксильной группы вследствие разрыва связи О – Н:
а) Взаимодействие с активными металлами с образованием алкоголятов металлов:
2С2Н5ОН + 2Na → 2С2Н5ОNa + H2
Эти реакции протекают только в безводной среде. В присутствии воды алкоголяты полностью гидролизуются и вновь образуется спирт.
Б). Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
С2Н5ОН + СН3СООН → СН3СООС2Н5 + Н2О
Реакции этерификации являются обратимыми реакциями.
2. Замещение гидроксильной группы вследствие разрыва связи С – О:
А). Взаимодействие с галогеноводородами с образованием галогеналканов:
С2Н5ОН + НCl → С2Н5Cl + Н2О
II. Реакции отщепления
1. Дегидратация, т. е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
А). Межмолекулярная дегидратация спиртов с образованием простых эфиров
R – O – R'. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
С2Н5ОН +С2Н5ОН → С2Н5-О-С2Н5+ Н2О
Б. Внутримолекулярная дегидратация спиртов с образованием алкенов.
Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
С2Н5ОН → С2Н4 + Н2О
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева: «При образовании воды наиболее легко отщепляется водород от соседнего наименее гидрогенизированного атома углерода»
2. Дегидрирование (разрыв связей «О – Н» и «С – Н»)
А. При дегидрировании первичных спиртов образуются альдегиды
В организме человека этот процесс происходит под действием фермента алкогольдегидрогенозы.
Б. При дегидрировании вторичных спиртов образуются кетоны.
В. Третичные спирты не дегидрируются.
III. Реакция окисления
1. Горение (полное окисление) Спирты горят на воздухе с выделением большого количества тепла:
С2Н5ОН + 3О2 → 2СО2 + 3Н2О +Q
2. Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования, приводит к образованию альдегидов (первичные спирты) и кетонов (вторичные спирты).
Таким образом, реакции дегидрирования спиртов по своей химической сущности являются реакциями окисления.
Вопросы и задания
1. Дайте определение спиртам. Предельные одноатомные спирты. Почему их так назвали? Напишите гомологический ряд предельных одноатомных спиртов из пяти первых спиртов.
2. Какие физические свойства спиртов обусловлены наличием водородной связи между молекулами спиртов.
3. Напишите формулу первичного, вторичного и третичного спирта для вещества, молекулярная формула которого С5Н11ОН.
4. Напишите структурные формулы веществ: а) 3-этил-1-пентанол, б) 2,2,4,4 –тетраметил-1-гептанол. Классифицируйте их по всем трем признакам.
5. Напишите структурные формулы двух изомеров и двух гомологов: а) 1- бутанола;
б) 2,3 – диметил,1- пентанола.
МНОГОАТОМНЫЕ СПИРТЫ. ГЛИЦЕРИН – ПРЕДСТАВИТЕЛЬ МНОГОАТОМНЫХ СПИРТОВ. ФЕНОЛ
План
1. Многоатомные спирты: номенклатура, свойства
2. Фенолы: строение, свойства, получение и применение
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Многоатомные спирты содержат две и более спиртовые гидроксильные группы.
Номенклатура:
Двухатомные спирты называются гликолями или диолами, трехатомные – глицеринами или триолами. Положение гидроксильных групп указывают цифрами. Этиленгликоль (1,2-этандиол); Пропиленгликоль (1,2-пропандиол) Глицерин (1,2,3-пропантриол).
Отдельные представители
Этиленгликоль (1,2-этандиол) - представитель предельных двухатомных спиртов – гликолей. Общая формула ряда гликолей СnH2n(OH)2. Название гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. “гликос”– сладкий). Этиленгликоль (1,2-этандиол) – сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.
Химические свойства этиленгликоля в основном соответствуют свойствам одноатомных спиртов. Только реакции протекают как по одной, так и по двум гидроксильным группам. В реакции со щелочными металлами этиленгликоль образует неполный и полный гликоляты. Качественной реакцией на многоатомные спирты является взаимодействие со свежеприготовленным гидроксидом меди (2). При этом осадок гидроксида меди (2) растворяется и образуется раствор ярко синего цвета.
Его можно получить при обработке дигалогенопроизводных углеводородов водным раствором щелочи.
Водные и спиртовые растворы этиленгликоля применяются как не замерзающие при низких температурах растворы, заменяющие воду в радиаторах автомобильных и авиационных моторов в зимних условиях – антифризы. В последнее время применяется для получения лавсана – ценного синтетического волокна.
Глицерин. Простейший представитель трехатомных предельных спиртов – глицеринов. Это бесцветная, вязкая, гигроскопичная жидкость, сладкая на вкус. Смешивается с водой в любых отношениях. Хорошо растворяет многие вещества.
По химическим свойствам близок к этиленгликолю. Большое значение имеет реакция взаимодействия глицерина с азотной кислотой с образованием нитроглицерина. Нитроглицерин – исторически сложившееся название – неточно: у нитросоединений, нитрогруппа непосредственно присоединена к углеродному атому. Правильнее его было бы отнести к эфирам. Нитроглицерин – эфир глицерина и азотной кислоты – тринитрат глицерина. Нитроглицерин – тяжелая маслянистая жидкость, взрывчатое вещество (взрывается от легкого сотрясения и нагревания).
Получают глицерин из жиров, а также синтетическим путем – из газов крекинга нефти (пропилена), т. е. из непищевого сырья.
Глицерин применяется для производства нитроглицерина, приготовления антифризов, в косметике (смягчает кожу), в кожевенной промышленности. Однопроцентный спиртовой раствор нитроглицерина используется как лекарство при сердечных заболеваниях (расширяет кровеносные сосуды).
ФЕНОЛЫ
Фенолы – это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп, непосредственно связанных с бензольным кольцом.
Одноатомный фенол (содержит одну гидроксогруппу), называется так же, как класс – фенол.
Физические свойства
Фенолы – бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом, трудно растворимые в воде, токсичны, являются антисептиками. При попадании на кожу вызывают ожоги.
Фенол – (карболовая кислота) С6Н5-ОН– бесцветное кристаллическое вещество, tплав = 43 ºС, tкип = 182 ºС, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 ºС смешивается с водой в любых соотношениях.
Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы – ОН и бензольного кольца.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
I. Кислотные свойства 1) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
С6Н5-ОН + NaOH → С6Н5ОNa + H2О
2) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами):
2С6Н5ОН + 2Na → 2С6Н5ОNa + H2
Образующиеся в результате реакции 1) и 2) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, угольная, вытесняет фенол из фенолятов (следовательно, фенол – еще более слабая кислота, чем угольная).
3) Взаимодействие с растворами солей – с раствором хлорида железа (III)
3С6Н5ОН + FeCl3 → (С6Н5О)3Fe + 3HCl
Данная реакция является качественной для фенола.
Феноляты используют в качестве исходных веществ для получения простых и сложных эфиров фенола.
II. Реакции с участием бензольного кольца.
Реакции замещения в бензольном кольце протекают легче, чем у бензола, и в более мягких условиях.
1. Галогенирование. Особенно легко происходит бромирование в водных растворах, при этом сразу образуется 2,4,6-трибромфенол.
2. Нитрование - с азотной кислотой образуется тринитрофенол.
2,4,6-Тринитрофенол, пикриновая кислота (желтое кристаллическое взрывчатое вещество)
III. Реакции присоединения идут в более жестких условиях, чем реакции замещения.
Гидрирование – присоединение водорода, образуется циклогексанол.
Способы получения
1. Из каменноугольной смолы. Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой.
2. Сплавление солей аренсульфокислот со щелочью.
3. Взаимодействием галогенопроизводных ароматических углеводородов со щелочами: или с водяным паром.
4. Кумольный способ.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям.
В результате этих процессов получают два ценных продукта – фенол и ацетон.
Влияние фенола на организм
В результате гидролиза аспирина образуется фенол.
Это должные знать те хозяйки, которые любят консервировать огурцы и помидоры и вместо уксусной кислоты добавляют таблетки аспирина.
НООС-С6Н4-О-СО-СН3 (аспирин) + Н2О (t) = НООС-С6Н4-ОН (гидроксибензойная к-та) + СН3СООН (уксусная к-та)
При нагревании салициловая кислота легко декарбоксилируется с образованием фенола:
С6H4(OH)COOH=C6H5OH + CO2
Но фенол и его производные без труда проникают в организм человека через кожу и желудочно-кишечный тракт, а пары фенола – через легкие.
В организме фенол легко образует соединения с другими веществами, присутствующими в организме. Чем выше концентрация фенола в крови, тем сильнее его неблагоприятное влияние на здоровье человека. Продукты взаимодействия фенола с другими веществами, а также часть несвязанного фенола выводятся с мочой.
Вопросы и задания
1. Многоатомные спирты - представители (этиленгликоль и глицерин): формулы молекулярные и структурные, получение, применение.
2. Фенолы – определение. Одноатомный фенол: физические свойства, характерные химические свойства (перечислить), получение и применение.
3. Напишите структурные формулы следующих соединений: 2,4-дихлорфенол;
4-этилфенол; 3-нитрофенол; 1,2,3-тригидроксибензол
(нумерация в фенолах начинается с того атома углерода, с которым связана гидроксогруппа, нумеровать внутри цикла)
4. В двух пробирках находятся глицерин и фенол. Предложите химические способы распознавания данных веществ.
ПОНЯТИЕ ОБ АЛЬДЕГИДАХ.
ФОРМАЛЬДЕГИД И АЦЕТАЛЬДЕГИД
План
1. Алдегиды: определение, классификация
2. Изомерия и номенклатура альдегидов
3. свойства альдегидов
Органические соединения, в молекуле которых имеется карбонильная группа, называют карбонильными соединениями или оксосоединениями.
Они делятся на две родственные группы – альдегиды и кетоны.
В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом: R-COH (R-CНО), а в молекулах кетонов – с двумя углеводородными радикалами: R-СО-R. Самый распространенный кетон – это ацетон (диметилкетон, пропанон). Его формула СН3-СО-СН3.
Углеводородные радикалы могут быть алифатическими (предельными или непредельными) и ароматическими.
Мы рассмотрим только предельные альдегиды.
Первый представитель альдегидов: Метаналь (Формальдегид, Муравьиный альдегид) НСОН. Второй альдегид – этаналь (Ацетальдегид. Уксусный альдегид) СН3-СОН.
Изомерия. Номенклатура
Общая формула предельных альдегидов CnH2nO или CnH2n+1– CHO.
Изомерия альдегидов связана только со строением углеродного скелета.
Альдегиды называют или по кислотам, в которые они переходят при окислении (с тем же числом углеродных атомов) или по предельным углеводородам с добавлением окончания – аль (систематическая номенклатура).
Примеры: Бутаналь (масляный альдегид) С3Н7-СОН. Пропаналь (пропионовый альдегид) С2Н5-СОН, Пентаналь (Валериановый альдегид) С4Н9-СОН.
Способы получения
1. Окисление первичных спиртов – важнейший способ получения альдегидов
а) окисление спирта дихроматом калия применяется преимущественно в лабораторных условиях;
б) окисление спирта кислородом воздуха в присутствии металлических катализаторов. В качестве катализатора в промышленности используется мелко раздробленная медь. При нагревании медь окисляется кислородом воздуха в оксид меди (II). Через систему пропускают пары метилового спирта, смешанные с воздухом.
Метиловый спирт окисляется оксидом меди, а образующаяся металлическая медь вновь окисляется кислородом воздуха. Таким образом, эти реакции повторяются неограниченное число раз. Реакция окисления метилового спирта оксидом меди является экзотермической, поэтому нагревание нужно только в начале реакции.
Этот способ лежит в основе технического получения некоторых альдегидов.
2. Из дигалогенопроизводных, имеющих оба галогена у одного и того же первичного атома углерода, альдегиды получаются в результате реакции замещения галогенов на гидроксилы.
Физические свойства
Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомов водорода с положительным зарядом. По этой причине температура кипения альдегидов значительно ниже, чем соответствующих спиртов. Низшие альдегиды – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде.
Химические свойства
Альдегиды вступают в очень большое число реакций, представляя собой одну из наиболее реакционноспособных групп соединений. Для удобства рассмотрения реакций альдегидов их можно разделить на группы в соответствии с теми атомами и группами атомов, которые присутствуют в молекуле альдегида:
I – атом водорода альдегидной группы, находящийся в непосредственном соседстве с карбонилом и потому обусловливающий легкую способность окисляться;
II – карбонильная группа, которая обусловливает большой ряд реакций присоединения к карбонилу и замещения атома кислорода карбонила;
III – радикал, который может участвовать в ряде реакций, свойственных остаткам углеводородов.
Таким образом, для альдегидов характерны реакции окисления, присоединения, полимеризации и поликонденсации.
I. РЕАКЦИИ ОКИСЛЕНИЯ
Альдегиды очень легко окисляются. Особенно характерно для альдегидов то, что такие слабые окислители, как некоторые оксиды и гидроксиды тяжелых металлов, которые не действуют на ряд других органических соединений, легко окисляют альдегиды с выделением свободных металлов или их закисей (“альдегидные реакции”).
1. Окисление аммиачным раствором оксидом серебра (реакция “серебряного зеркала”).
Если к прозрачному бесцветному аммиачному раствору оксида серебра* прибавить раствор альдегида и нагреть жидкость, то на стенках пробирки при достаточной чистоте их образуется налѐт металлического серебра в виде зеркала; если же стенки пробирки недостаточно чисты, то металлическое серебро выделяется в виде светло-серого осадка. Альдегид при этом окисляется в кислоту с тем же числом атомов углерода, что и в исходном альдегиде.
2. Окисление гидроксидом меди (II)
Если к жидкости со светло-голубым осадком гидроксида меди (II) прибавить раствор, содержащий альдегид, и нагреть смесь, то вместо голубого осадка появляется желтый осадок гидрокисида меди (I) CuOH, который при дальнейшем нагревании образует осадок красного цвета Cu2O (оксид меди I). Альдегид при этом превращается в кислоту.
II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Реакции присоединения к карбонилу альдегидов
При протекании этих реакций в большинстве случаев первой стадией является присоединение к положительно заряженному атому углерода карбонила отрицательно заряженной частицы (например, аниона ОН¯).
Гидрирование (восстановление) с образованием первичных спиртов RCH2OH.
Применение важнейших альдегидов
Метаналь используют для получения: антисептиков, полимеров, 40-% раствор используют для хранения влажных анатомических препаратов.
Этаналь – исходное сырье для получения этилового спирта, уксусной кислоты, уксусного ангидрида, лекарственных веществ, ацетата целлюлозы, из которой получают ацетатный шелк. Этаналь используют для получения диеновых углеводородов, из которых получают синтетические каучуки.
Задания.
Задание 1: Составить конспект по указанной теме по нижеприведенному плану.
| 1. Определение альдегидов, их общая формула. |
|
| 2. Гомологический ряд альдегидов (приведите сокращенные структурные формулы первых шести гомологов метаналя и их названия в системе ИЮПАК, тривиальные названия). | С1: НСНО (или НСОН) – метаналь (муравьиный альдегид, формальдегид); С2:... С3: СН3-СН2-СНО (или СН3-СН2-СОН) – пропаналь (пропионовый альдегид) С4:… С5:… С6:… |
| 3 Изомерия и номенклатура альдегидов. Вид изомерии – изомерия положения углеродной цепи | (рассмотреть на примере С6Н12О, привести сокращенные структурные формулы изомеров и назвать каждый изомер. Нумерация атомов С в углеродной цепи начинается с атома С альдегидной группы -1СНО) |
| 4. Свойства альдегидов на примере этаналя (составить уравнения реакций в структурном виде, указать условия протекания реакций, все вещества назвать): А) окисления: +Cu(OH)2 (качественная реакция на альдегидную группу) +Ag2O(аммиачный раствор) (качественная реакция на альдегидную группу) Б) реакции восстановления: |
|
Задание 2: Применение метаналя и этаналя.
КАРБОНОВЫЕ КИСЛОТЫ: ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
Карбоновыми кислотами называются производные углеводородов, молекулы которых содержат одну или несколько карбоксильных групп: - СООН. Эта сложная группа состоит из двух простых групп: карбонильной - С = О и гидроксидной – ОН.
Водород карбоксильной группы обуславливает кислые свойства, а количество карбоксильных групп в молекуле кислоты определяет ее основность.
Предельные одноосновные кислоты – содержат одну группу – СООН.
Они образуют гомологический ряд с общей формулой: CnH2n+1COOH.
Здесь карбоксил соединен с углеводородным радикалом. Простейшим представителем этого ряда является муравьиная кислота, у которой карбоксил соединен не с углеводородным радикалом, а с атомом водорода.
Для низших членов ряда карбоновых кислот употребляются тривиальные названия: муравьиная кислота, уксусная, масляная и т. д. По рациональной номенклатуре пользуются названием, где сложная кислота рассматривается как производное уксусной или другой менее сложной кислоты. По современным международным правилам название карбоновой кислоты составляется добавлением к названию углеводорода окончания
-ОВАЯ и слово «кислота». Углеродный атом карбоксильной группы определяет начало нумерации и входит в счет атомов главной углеродной цепи.
Названия некоторых карбоновых кислот:
H – COOH Муравьиная (Метановая кислота)
CH3 – COOH Уксусная (Этановая кислота)
С6H5COOH Бензойная кислота
C6H5CH2COOH Фенилуксусная
Природные источники и способы получения
В природных условиях некоторые кислоты встречаются в свободном состоянии (муравьиная в муравьях) или, гораздо чаще в виде сложных эфиров.
1. Из сложных эфиров свободные кислоты получают путем омыления.
Ароматические кислоты в свободном состоянии и в виде сложных эфиров входят в состав ряда смол: бензойной смолы, толуанского и перуанского бальзамов.
Бензойную кислоту вначале получали путем возгонки бензойной смолы (в дальнейшем синтетические способы вытеснили этот способ.)
2. Из альдегидов (и первичных спиртов) кислоты получаются путем их окисления
3. Из моногалогенопроизводных углеводородов кислоты можно получать различными путями.
4. Из трех галогенпроизводных углеводородов (с галогенами стоящими у одного и того же атома углерода) кислоты получаются при их нагревании с растворами едких щелочей
5. Ароматические кислоты легко получаются окислением боковых цепей ароматических углеводородов. Например, при кипячении толуола с раствором KMnO4, особенно быстро в кислой среде, происходит окисление толуола в бензойную кислоту.
Физические свойства
Низшие представители класса алифатических кислот – легкоподвижные жидкости, далее, начиная с валериановой кислоты, идут кислоты, имеющие характер маслянистых жидкостей, высшие – твердые вещества.
Простейшие кислоты смешиваются с водой в любых соотношениях, кислоты, начиная с валериановой, растворяются в воде в известных пределах; высшие представители в воде не растворяются.
В спирте и в эфире все кислоты хорошо растворимы.
Химические свойства
Для удобства рассмотрения свойств и реакций карбоновых кислот их можно разделить на группы в соответствии с теми атомами и группами атомов, которые входят в их молекулы:
1. Свойства водорода в карбоксиле кислот
А. Диссоциация кислот.
Все карбоновые кислоты, подобно неорганическим кислотам, обладают кислыми свойствами, окрашивая лакмус в красный цвет. Это явление обусловлено диссоциацией кислот, т. е расщеплением их на ионы. В водном растворе существует равновесие. Как правило, карбоновые кислоты значительно слабее, чем минеральные, т. е. степень диссоциации карбоновых кислот гораздо меньше.
Из карбоновых кислот наиболее сильной является муравьиная.
Ароматические кислоты диссоциированы в большей степени, чем жирные. В этом проявляется влияние остатка бензола.
Б. Замещение водорода карбоксила кислоты металлом происходит при взаимодействии с некоторыми достаточно энергичными металлами (реакция с щелочными металлами протекает обычно бурно), оксидами некоторых металлов и щелочами (нейтрализация) с образованием солей.
Так как органические кислоты слабые, то соли их в водных растворах обычно сильно гидролизованы
2. Свойства гидроксида карбоксильной группы
А. Замещение гидроксильной группы на галогены:
R-COOH + НCl → R-COСl + H2О
Образуются ангидриды кислот (например, хлорангидрид уксусной кислоты, если реакция была с уксусной кислотой)
Б. Замещение гидроксила в карбоксиле остатком спирта приводит к образованию сложных эфиров, при этом образуются сложные эфиры:
R-COOH + С2Н5ОН → R-COОС2Н5 + H2О
Один из простейших способов перевода кислот в сложные эфиры – нагревание кислот со спиртами в присутствии водоотнимающих веществ (H2SO4 , HCl и др.).
Реакция носит название реакция этерификации.
В. Замещение гидроксила в карбоксиле остатком аммиака – аминогруппой NH2 – приводит к образованию амидов кислот.
Практически амиды легко получить из галогенангидридов кислот, действуя аммиаком.
3. Свойства карбонильной группы
Кислоты, подобно альдегидам и кетонам, содержат карбонильную группу. Однако, в то время как карбонильная группа альдегидов (в меньшей степени кетонов) обуславливает ряд реакций, карбонильная группа свободных кислот при обычных условиях такими свойствами не обладает.
Например, реакция присоединения водорода, протекающая легко с альдегидами и кетонами и приводящая к восстановлению их в спирты, с кислотами в столь мягких условиях не протекает. Лишь при помощи особых каталитических методов с большим трудом удается перевести кислоты в альдегиды и спирты.
4. Свойства радикала карбоновых кислот Атомы водорода в радикале кислот способны замещаться, например, при действиях галогенов. В этом случае получаются галогенокислоты, которые являются производными кислот, у которых один или несколько атомов водорода в радикале замещены галогенами. При действии хлора на уксусную кислоту получаются хлоруксусные кислоты.
При достаточном количестве галогена реакция идет дальше. С замещением второго и третьего атома водорода, например трихлоруксусная кислота. Галогенирование кислот ускоряется при действии солнечного света, а также катализаторов, например следов иода.
Атомы водорода в остатке бензола в ароматических кислотах могут замещаться так же, как в ароматических углеводородах, различными атомами и группами атомов. При замещении атомов водорода галогеном получаются галогенокислоты.
В результате замещения атомов водорода нитрогруппой получаются нитробензойные кислоты.
Отдельные представители (муравьиная кислота, уксусная кислота)
Муравьиная кислота, или метановая кислота, – простейший представитель класса кислот. В свободном состоянии встречается в организме и едких выделениях муравьев, жгучей крапиве и в небольших количествах в моче и поте животных. Муравьиная кислота – едкое вещество: капли ее вызывают на коже пузыри. Применяется при крашении тканей в составе закрепителей. В промышленности муравьиную кислоту получают нагреванием окиси углерода с порошкообразным едким натром с последующей обработкой образовавшегося формиата натрия разбавленной серной кислотой. Технический продукт после перегонки представляет собой 85%-ю муравьиную кислоту. Муравьиная кислота отличается рядом особенностей. Под влиянием водоотнимающих веществ муравьиная кислота разлагается. Эта реакция используется для получения чистой окиси углерода.
Уксусная кислота CH3COOH широко распространена в природе: содержится в выделениях животных (моче, желчи), в растениях (в зеленых листьях), образуется при брожении, скисании вина, пива, содержится в кислом молоке и сыре. Безводная уксусная кислота имеет температуру плавления + 16,6 °С, кристаллы ее прозрачны, как лед, поэтому ее назвали «ледяной уксусной кислотой». Впервые была получена в таком виде в конце XVIII-го в. русским ученым Т. Е. Ловицем. Обычная техническая уксусная кислота имеет концентрацию 70–80 %. Большое количество уксусной кислоты используется при синтезе красителей. В красильной промышленности используют способность уксусной кислоты гидролизоваться.
Уксусная кислота в промышленности производится окислением ацетальдегида кислородом воздуха в присутствии марганцевых катализаторов, уксуснокислым брожением жидкостей, содержащих этиловый спирт.
Сухая перегонка древесины. Способ сейчас имеет значение лишь для утилизации отходов лесотехнической промышленности.
Из углеводородов нефти – прямым окислением бутана (200 ºС; 50 кгс/см2 )
Из ацетилена по реакции Кучерова получают уксусный альдегид (ацетальдегид), который окисляют далее в уксусную кислоту.
Вопросы и задания
Задание 1. Составить конспект по указанной теме по нижеприведенному плану.
| 1. Определение карбоновых кислот, их общая формула, строение первого члена карбоновых кислот (метановой, или муравьиной кислоты) |
|
| К Классификация карбоновых кислот по углеводородному радикалу (привести по одному примеру и дать названия) | П Предельные:…
Н Непредельные:…
А Ароматические:… |
| 2. Гомологический ряд предельных карбоновых кислот (приведите неполные структурные формулы первых шести гомологов муравьиной кислоты и их названия в системе ИЮПАК, а также тривиальные названия). | С1: НСООН – метановая (муравьиная) кислота; С2:... С3: СН3-СН2-СООН) – пропановая (пропионовая) кислота С4:… С5:… С6:… |
| 3 Изомерия и номенклатура карбоновых кислот. В вид изомерии - изомерия положения углеродной цепи | ( Рассмотреть на примере С6Н12О2, привести неполные структурные формулы трех изомеров, правильно пронумеровать и дать названия. Нумерация атомов С в углеродной цепи начинается с атома С карбоксильной группы -1СООН) |
| 4. Свойства карбоновых кислот (составить уравнения реакций на примере уксусной кислоты, указать условия протекания реакций, все вещества назвать): +лакмус (уравнение Э.Д.) +Mе – взаимодействие с металлом Mg +MехOу - – взаимодействие с оксидами металлов; +Ме(OH)n - – взаимодействие с основаниями; +MeK.O. (NaHCO3) - – взаимодействие с с солями более слабых кислот. 5. Реакция этерификаци |
Заполнить таблицу
|
Задание 2. Заполнить таблицу:
название солей карбоновых кислот
| Кислота | Формула | Соль кальция | Название соли |
| пропионовая | С2Н5СООН | (С2Н5СОО)2Са | Пропионат кальция |
|
|
|
|
|
|
|
|
|
|
Задание 3. Напишите структурные формулы следующих веществ: а) 2,2-диметилпропионовая кислота; б) 2-этил, 3-гидроксипентановая кислота
СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ
1. Сложные эфиры – это органические вещества, образованные реакцией этерификации органических кислот со спиртами.
Сложные эфиры можно рассматривать, как производные карбоновых кислот, в которых
атом водорода карбоксильной группы замещен на углеводородный радикал.
Номенклатура
Названия сложных эфиров производят от названия углеводородного радикала спирта и
названия кислоты с добавлением суффикса –ат, используют также названия , образованные из названия кислот и спиртов, дающих эфир.
Например, НСООСН3 метилформиат (метиловый эфир муравьиной кислоты);
НСООС2Н5 этилформиат (этиловый эфир муравьиной кислоты);
СН3СООС2Н5 этилацетат (этиловый эфир уксусной кислоты)
Физические свойства
Сложные эфиры широко распространены в природе. Аромат многих цветов, плодов, ягод
обусловлен присутствием в них сложных эфиров.
Эфиры низших одноатомных спиртов и низших кислот – летучие жидкости с приятным
запахом цветов, фруктов. Эти эфиры используют в парфюмерной и пищевой промышленности как «фруктовые эссенции». Они мало растворимы в воде, хорошо растворяются в органических растворителях, сами являются растворителями. Между молекулами эфиров не образуется водородная связь, поэтому они имеют не высокие температуры кипения.
2. Жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Классификация жиров:
Жиры бывают твёрдые (животные) и жидкие (растительные: исключение кокосовое
масло).
Твёрдые жиры содержат остатки предельных карбоновых кислот, жидкие – непредельных.
Химические свойства:
А) Гидрирование жидких жиров. Жидкие жиры легко переводятся в твердые при реакции гидрирования
СН2-О- СО-С17Н33 Ni СН2-О- СО-С17Н35
СН -О- СО-С175Н33 +3Н2 ===== СН - О- СО-С17Н35
СН2-О- СО-С17Н33 СН2- О- СО-С17Н35
Триолеат (жидкий) тристеарат (твёрдый)
«саломас» - основа маргарин
Б) Все жиры, как сложные эфиры подвержены реакции гидролиза, при этом образуется спирт глицерин и высшая карбоновая кислота. Эта реакция обратная реакции этерификации.
В) Реакции омыления. При гидролизе природных жиров образуются высшие карбоновые кислоты, которые идут на производство мыла (путем взаимодействия их со щёлочью и образования натриевых или калиевых солей).
В современном производстве моющих средств большая часть мыла производиться из кислот, полученных при переработке нефти, так как жиры более ценны как продукты питания.
Превращение жиров в организме происходит по следующей схеме: сначала жиры под действием ферментов поджелудочного и кишечного соков расщепляются в тонких кишках на глицерин и кислоты. Всасываются ворсинками кишечника и снова образуют жир, свойственный уже данному организму. Этот жир по лимфатической системе поступает в кровь и переносится ею в жировую ткань. Отсюда жиры поступают в другие органы и ткани, где в процессе постоянного обмена веществ в клетках вновь подвергаются гидролизу и последующему окислению до оксида углерода (IV) и воды.
У мыла есть один существенный недостаток чем жестче вода тем меньше моющая способность мыла. (Жесткая вода содержит растворимые соли кальция и магния).
Для решения данной проблемы используются Синтетические Моющие Средства (СМС). Данные вещества образуют растворимые соли кальция и поэтому не теряют моющих свойств в любой воде. Существует проблема утилизации остатков СМС попадающих в окружающую среду. Поэтому, создавая новые препараты, стремятся обеспечить не только высокие моющие свойства, но и биоразлагаемость этих веществ – последующее уничтожение в природе некоторыми видами микроорганизмов.
Задания:
1. Сложные эфиры – определение, физические свойства, нахождение в природе.
2. Написать структурные формулы эфиров: пропиловый эфир муравьиной кислоты (пропилформиат), этиловый эфир пропионовой кислоты (этилпропионат)
3. Жиры – определение, классификация (привести по три примера). Перечислить химические свойства, характерные для жиров
4. Выполнить тестовое задание по вариантам (нечетные номера студентов в списке группы – 1 вариант, четные – 2 вариант)
Тест по теме «Кислородсодержащие органические вещества»
1 вариант
1. Выберите, какая функциональная группа соответствует кетонам:
1)альдегидная, 2)карбонильная, 3)гидроксильная,4)карбоксильная.
2. Какое из перечисленных свойств не характерно для спиртов при нормальных условиях:
1)жидкости, 2) резкий запах, 3)газы, 4) растворимые в воде.
3. С помощью, какой реакции нельзя получить карбоновую кислоту
1)окисление альдегида, 2)восстановление альдегида,
3)окисление алкана 4).восстановление алкена.
4. Сколько перечисленных веществ реагируют с этаналем: муравьиная кислота, водород, магний, гидросульфит натрия, гидроксид меди (II)
1) два, 2) три, 3) четыре, 4) пять.
5. Какой объём водорода (н. у.) выделится при взаимодействии 0,1 моль этанола с избытком металлического натрия
1) 2,24 л 2) 1,12 л 3) 3,36 л 4) 4,48 л.
2 вариант
1. Выберите, какая функциональная группа соответствует спиртам:
1)альдегидная, 2)карбонильная, 3 )гидроксильная,4) карбоксильная.
2. Какое из перечисленных свойств не характерно для метаналя при нормальных условиях:
1 )жидкости, 2) резкий запах, 3)газы, 4) растворимые в воде.
3. Образование ярко-синего раствора при взаимодействии с гидроксидом меди (II) является качественной реакцией на
1) альдегиды 2) многоатомные спирты 3) фенолы 4) карбоновые кислоты
4. Сколько перечисленных веществ реагируют с уксусной кислотой: магний, гидроксид железа (II), пропанол-1, хлор (в присутствии катализатора), карбонат натрия, формальнальдегид.
1) шесть, 2) три, 3) четыре, 4) пять.
5. Какой объём водорода (н. у.) выделится при взаимодействии 0,1 моль пентановой кислоты с избытком металлического цинка
1) 2,24 л 2) 1,12 л 3) 3,36 л 4) 4,48 л.
Критерии оценивания:
Оценка: «удовлетворительно» - выполнены три первых задания;
Оценка: « хорошо» - выполнены три первых задания и 4 тестовых вопроса;
Оценка: «отлично» - выполнены все задания и тестовые вопросы. 5 тестовый вопрос оформить с расчетом.
СУЩЕСТВУЮТ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, КОТОРЫЕ СОДЕРЖАТ НЕСКОЛЬКО ФУНКЦИОНАЛЬНЫХ ГРУПП
УГЛЕВОДЫ
КЛАССИФИКАЦИЯ. ГЛЮКОЗА
Углеводы служат важным источником питания. Самая гигиеничная одежда сделана из целлюлозы или продуктов на её основе: хлопка и льна, вискозного волокна или ацетатного шелка. Деревянные дома и мебель построены из той же целлюлозы, образующей древесину. В основе производства фото- и кинопленки все та же целлюлоза. Книги, газеты, денежные банкноты – всё это продукция целлюлозно-бумажной промышленности. Значит, углеводы обеспечивают нас всем необходимым.
Кроме того, углеводы участвуют в построении сложных белков, ферментов, гормонов. Углеводами являются и такие жизненно необходимые вещества, как гепарин (он играет важнейшую роль - предотвращает свертывание крови).
Единственным источником энергии на Земле (помимо ядерной) является энергия Солнца, а единственным способом его аккумулирования для обеспечения жизнедеятельности всех живых организмов, является процесс фотосинтеза, протекающий в клетках растений и приводящий к синтезу углеводов из воды и углекислого газа.
Кстати, именно при этом превращении образуется кислород, без которого жизнь на нашей планете была бы невозможна.
1. Понятие об углеводах. Классификация углеводов
С соединениями этого класса вы уже знакомы из курса биологии и имеете представление о роли углеводов в природе, их значении для жизни.
Значение углеводов для живых организмов, для жизни трудно переоценить, они участвуют во всех жизненно важных процессах. Одна из важнейших реакций, протекающих в природе – реакция фотосинтеза. Ежегодно зеленые растения и бактерии поглощают в процессе фотосинтеза около 200 млрд. тонн углекислого газа. При этом в атмосферу высвобождается приблизительно 130 млрд. тонн кислорода и синтезируется 50 млрд. тонн органических соединений.
Углеводы аккумулируют солнечную энергию и сами являются источником энергии для живых организмов.
Углеводы - обширный класс природных соединений, которые играют важную роль в жизни человека, животных и растений.
Название «углеводы» эти соединения получили потому, что состав многих из них выражается общей формулой Сn(H2O)m, т.е. формально являются соединениями углерода и воды. С развитием химии углеводов обнаружены соединения, состав которых не отвечает приведенной формуле, но обладающие свойствами веществ своего класса (например, дезоксирибоза С5Н10О4). В то же время есть вещества, соответствующие общей формуле углеводов, но не проявляющие их свойства (например, муравьиный альдегид– СН2О, уксусная кислота - С2Н4О2).
Все углеводы можно разделить на две группы: простые углеводы (моносахариды) и сложные углеводы.
Простые углеводы (моносахариды) – это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов.
Сложные углеводы – это углеводы, молекулы которых состоят их двух или более числа остатков моносахаридов и разлагаются на эти моносахариды при гидролизе.
Одним из важнейших моносахаридов является глюкоза. Молекулярная формула глюкозы: С6Н12О6. Следовательно, глюкоза относится к кислородсодержащим органическим веществам.
I. Моносахариды
Моносахариды представляют собой соединения со смешанными функциями. Они содержат альдегидную или кетогруппу и несколько гидроксильных групп, т.е. являются альдегидоспиртами или кетоноспиртами.
Моносахариды с альдегидной группой называются альдозами, а с кетогруппой – кетозами.
По числу углеродных атомов в молекуле моносахариды делятся на тетрозы, пентозы, гексозы и т.д.
Наибольшее значение среди моносахаридов имеют гексозы и пентозы.
Структура моносахаридов
Для изображения строения моносахаридов используют проекционные формулы Фишера. В формулах Фишера цепь углеродных атомов располагается в одну цепь. Нумерация цепи начинается с атома альдегидной группы (в случае альдоз) или с крайнего атома углерода, к которому ближе расположена кетогруппа (в случае кетоз).
В состав глюкозы входит 5 гидроксогрупп, это доказано реакцией ее с уксусной кислотой. Глюкоза образует сложный эфир с пятью молекулами уксусной кислоты.

Однако, моносахариды могут существовать также в циклических формах. В растворах моносахаридов устанавливается подвижное равновесие между ациклической и циклической формами – таутомерия.
Циклические формы принято изображать перспективными формулами Хеуорса.
В циклических формах моносахаридов появляется асимметрический атом углерода (С-1 у альдоз, С-2 у кетоз). Этот атом углерода называется аномерным. Если группа ОН у аномерного атома располагается под плоскостью, то образуется α–аномер, противоположное расположение приводит к образованию β-аномера.
Физические свойства и нахождение в природе
Глюкоза представляет собой бесцветное кристаллическое вещество, хорошо растворимое в воде, плохо растворимое в спирте, сладкое на вкус («глюкос» — сладкий). Сладость моносахаридов различна. Глюкозу называют виноградным сахаром, т. к она содержится в большом количестве в соке винограда. Кроме винограда глюкоза содержится и в других сладких плодах и даже в разных частях растений.
Распространена глюкоза и в животном мире. Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций. Уровень глюкозы в крови человека постоянен и находится в пределах 0,08-0,11%. Во всем объеме крови взрослого человека содержится 5-6 г. глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 мин. его жизнедеятельности.
При некоторых патологиях, например, при заболевании сахарным диабетом, содержание глюкозы в крови повышается, и избыток её выводится с мочой. При этом количество глюкозы в моче может возрасти до 12% против обычного – 0,1%.
Наиболее важная из кетоз - фруктоза. Она является изомером глюкозы. Содержится во фруктах, в пчелином меде. Фруктоза слаще глюкозы примерно в три раза.
Химические свойства
Химические свойства моносахаридов обусловлены особенностями их строения.
Рассмотрим химические свойства на примере глюкозы. По характеру глюкоза является альдегидоспиртом, следовательно, должны идти реакции по альдегидной и спиртовой группе.
1. Реакции с участием альдегидной группы глюкозы
а) восстановление (гидрирование) с образованием многоатомного спирта сорбита
СН=О СН2ОН
│ kat, t0 │
(СНОН)4 + Н2 → (СНОН)
│ │
СН2ОН СН2ОН
б) неполное окисление:
- реакция «серебряного зеркала» ( с аммиачным раствором оксида серебра,t0),
CH=O COOH
│ NH4OH, t0 │
(CHOH)4 + Ag2O → (CHOH)4 + 2Ag
│ │
CH2OH CH2OH
Продуктом окисления является глюконовая кислота (соль этой кислоты – глюконат кальция – известное лекарственное средство).
- реакция нагревания со свежеприготовленным гидроксидом меди (2):
CH=O COOH
│ t0 │
(CHOH)4 + 2Cu(OH)2 → (CHOH)4 + Cu2O↓ + 2H2O
│ голубой │ кирпично-красный
CH2OH CH2OH
Эти реакции являются качественными на глюкозу как альдегид.
2. Реакция глюкозы с участием гидроксильных групп (т.е. свойства глюкозы как многоатомного спирта)
а) взаимодействие с Cu(OH)2 на холоду с образованием глюконата меди (II) – качественная реакция на глюкозу как многоатомный спирт, образуется раствор ярко синего цвета.
б) взаимодействие с уксусной кислотой – реакция этерификации (образование пентаацетата глюкозы)
3. Брожение (ферментация) моносахаридов – специфические свойства глюкозы
а) спиртовое брожение
С6Н12О6 → 2С2Н5ОН + 2СО2
б) маслянокислое брожение
С6Н12О6 → СН3 ─СН2 ─ СН2 ─СООН + 2Н2↑ + 2СО2↑
в) молочнокислое брожение
С6Н12О6 → 2СН3 ─ СН ─ СООН
│
ОН
Получение:
1. В промышленности – гидролиз крахмала
(С6Н10О5)n + nH2O → nС6Н12О6
2. В лаборатории – нагревание формальдегида с гидроксидом кальция
6СН2О → С6Н12О6
(Гидроксид кальция – катализатор, ускоряет реакцию, но сам при этом не расходуется).
3. В природе – фотосинтез
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений.
Суммарное уравнение фотосинтеза:
6СО2 + 6Н2О → С6Н12О6 + 6О2
В живых организмах происходит окисление глюкозы под действием кислорода воздуха по обратной реакции:
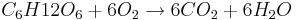
Применение:
- в медицине, микробиологической промышленности;
- для получения этанола;
- в кондитерской промышленности в составе патоки;
- для изготовления зеркал и елочных украшений;
- в текстильной промышленности.
Задания:
Задание 1. Заполните таблицу
| 1. Определение и классификация углеводов (привести примеры) |
|
| 2. Моносахариды – глюкоза и фруктоза: а) нахождение в природе б) строение (желательно структурные формулы); в) глюкоза – альдегидоспирт (доказать уравнениями реакций по альдегидной и по спиртовой группе); г) получение глюкозы (в природе, лаборатории, промышленности, подтвердить уравнениями реакций) |
|
Задание 2. Значение углеводов для живых организмов
ДИСАХАРИДЫ. ПОЛИСАХАРИДЫ
II. Дисахариды – продукты конденсации двух моносахаридов.
Важнейшие природные представители:
сахароза (тростниковый или свекловичный сахар) – образована из остатков α-глюкозы и β-фруктозы;
мальтоза (солодовый сахар) – состоит из двух остатков глюкозы, содержится в меде, солоде, пиве, патоке, проросшем зерне;
лактоза (молочный сахар) – состоит из остатков глюкозы и галактозы, содержится только в молоке;
целлобиоза – образована из остатков β-глюкозы, является составной частью целлюлозы.
Все они имеют одну молекулярную формулу С12Н22О11, т.е. являются изомерами.
Дисахариды – типичные сахароподобные углеводы; это твердые кристаллические вещества, имеющие сладкий вкус.
Строение
Молекулы дисахаридов могут содержать два остатка одного моносахарида или два остатка разных моносахаридов;
Химические свойства
1. Все дисахариды являются многоатомными спиртами, для них характерны свойства многоатомных спиртов, они дают качественную реакцию на многоатомные спирты – реакция с Cu(OH)2 на холоду.
2. Все дисахариды гидролизуются с образованием моносахаридов:
Н+, t0
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
В живых организмах гидролиз идет под действием ферментов.
III. Полисахариды (С
6Н
10О
5)
n - высокомолекулярные соединения, при полном гидролизе образуют молекулы моносахаридов.
А). Крахмал — белый аморфный порошок, не растворяется в холодной воде. В горячей воде он разбухает и образует коллоидный раствор — крахмальный клейстер.
Крахмал содержится в цитоплазме растительных клеток в виде зерен запасного питательного вещества. В картофельных клубнях содержится около 20 % крахмала, в пшеничных и кукурузных зернах — около 70 %, а в рисовых — почти 80 %.
Б). Целлюлоза (от лат. cellula — клетка), выделенная из природных материалов (например, вата или фильтровальная бумага), представляет собой твердое волокнистое вещество, нерастворимое в воде.
Оба полисахарида имеют растительное происхождение, однако играют в клетке растений разную роль: целлюлоза — строительную, конструкционную функцию, а крахмал — запасающую. Поэтому целлюлоза является обязательным элементом клеточной оболочки растений. Волокна хлопка содержат до 95 % целлюлозы, волокна льна и конопли — до 80 %, а в древесине ее содержится около 50 %.
Строение крахмала и целлюлозы
Состав этих полисахаридов можно выразить общей формулой (C6H10O5)n. Число повторяющихся звеньев в макромолекуле крахмала может колебаться от нескольких сотен до нескольких тысяч. Целлюлоза же отличается значительно большим числом звеньев и, следовательно, молекулярной массой, которая достигает нескольких миллионов.
Различаются углеводы не только молекулярной массой, но и структурой. Для крахмала характерны два вида структур макромолекул: линейная и разветвленная. Линейную структуру имеют более мелкие макромолекулы той части крахмала, которую называют амилозой, а разветвленную структуру имеют молекулы другой составной части крахмала — амилопектина.
В крахмале на долю амилозы приходится 10— 20 %, а на долю амилопектина — 80-90 %. Амилоза крахмала растворяется в горячей воде, а амилопектин только набухает.
Структурные звенья крахмала и целлюлозы построены по-разному. Если звено крахмала включает остатки α-глюкозы, то целлюлоза — остатки β-глюкозы, ориентированные в природные волокна.
Химические свойства полисахаридов
1. Гидролиз
Крахмал и целлюлоза подвергаются гидролизу с образованием глюкозы в присутствии минеральных кислот, например серной:

В пищеварительном тракте животных крахмал подвергается сложному ступенчатому гидролизу:
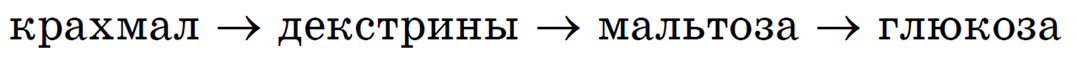
Организм человека не приспособлен к перевариванию целлюлозы, так как не имеет ферментов, необходимых для разрыва связей между остатками β-глюкозы в макромолекуле целлюлозы.
Лишь у термитов и жвачных животных (например, коров) в пищеварительной системе живут микроорганизмы, вырабатывающие необходимые для этого ферменты.
2. Образование сложных эфиров
Крахмал может образовывать эфиры за счет гидроксигрупп, однако эти эфиры не нашли практического применения.
Каждое звено целлюлозы содержит три свободных спиртовых гидроксигруппы. Поэтому общую формулу целлюлозы можно записать таким образом:
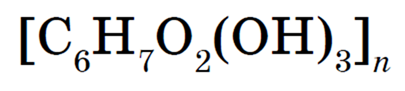
За счет этих спиртовых гидроксигрупп целлюлоза и может образовывать сложные эфиры, которые широко применяются.
При обработке целлюлозы смесью азотной и серной кислот получают в зависимости от условий моно-, ди- и тринитроцеллюлозу:

Применение углеводов
Смесь моно- и динитроцеллюлозы называют коллоксилином. Раствор коллоксилина в смеси спирта и диэтилового эфира — коллодий — применяют в медицине для заклеивания небольших ран и для приклеивания повязок к коже.
При высыхании раствора коллоксилина и камфары в спирте получается целлулоид — одна из пластмасс, которая впервые стала широко использоваться в повседневной жизни человека (из нее делают фото- и кинопленку, а также различные предметы широкого потребления).
Растворы коллоксилина в органических растворителях применяются в качестве нитролаков. А при добавлении к ним красителей получаются прочные и эстетичные нитрокраски, широко используемые в быту и технике.
Как и другие органические вещества, содержащие в составе молекул нитрогруппы, все виды нитроцеллюлозы огнеопасны. Особенно опасна в этом отношении тринитроцеллюлоза — сильнейшее взрывчатое вещество. Под названием «пироксилин» она широко применяется для производства оружейных снарядов и проведения взрывных работ, а также для получения бездымного пороха.
С уксусной кислотой (в промышленности для этих целей используют более мощное этерифицирующее вещество — уксусный ангидрид) получают аналогичные (ди- и три-) сложные эфиры целлюлозы и уксусной кислоты, которые называются ацетилцеллюлозой:
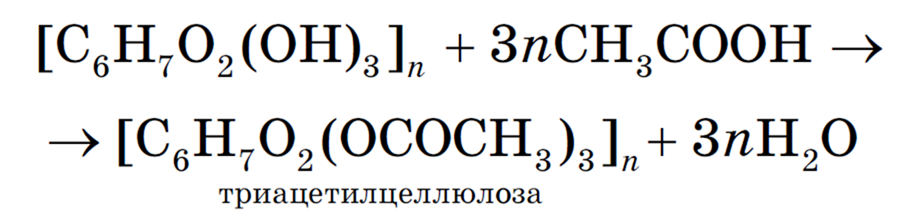
Ацетилцеллюлозу используют для получения лаков и красок, она служит также сырьем для изготовления искусственного шелка. Для этого ее растворяют в ацетоне, а затем этот раствор продавливают через тонкие отверстия фильер (металлических колпачков с многочисленными отверстиями). Вытекающие струйки раствора обдувают теплым воздухом. При этом ацетон быстро испаряется, а высыхающая ацетилцеллюлоза образует тонкие блестящие нити, которые идут на изготовление пряжи.
Крахмал, в отличие от целлюлозы, дает синее окрашивание при взаимодействии с йодом. Эта реакция является качественной на крахмал или йод в зависимости от того, наличие какого вещества требуется доказать.
Задание: 1. составить краткий конспект по дисахаридам;
2. полисахариды:
сравнение крахмала и целлюлозы оформить в виде таблицы
| Признаки сравнения | Крахмал | Целлюлоза |
| 1. Содержание в природе |
|
|
| 2. Строение |
|
|
| 3. Физические свойства |
|
|
| 4. Химические свойства А) гидролиз Б) образование сложных эфиров В) качественная реакция |
|
|
| 4. Применение |
|
|
| Вывод |
|
|
ОСНОВНАЯ литература:
Ерохин Ю. М. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ. учреждений сред. проф. образования – М.: Академия, 2015 – 448 с. [Электронный ресурс; Режим доступа http://www.academia-moscow.ru] – ДЛЯ ОНЛАЙН-ЧТЕНИЯ НА САЙТЕ ИЗДАТЕЛЬСТВА ПРИ НАЛИЧИИ КОДА ДОСТУПА;
Ерохин Ю. М. Химия: учебник для студ. учреждений сред. проф. образования – М.: Академия, 2014 – 395 с. [Электронный ресурс; Режим доступа https://obuchalka.org/2016072390168/himiya-erohin-u-m-2014.html] – МОЖНО СКАЧАТЬ УЧЕБНИК;
Ерохин Ю. М. Химия: учебник для студ. учреждений сред. проф. образования – М.: Академия, 2014 – 395 с. [Электронный ресурс; Режим доступа https://docs.google.com/viewer?url=https://s.11klasov.ru/index.php?do%3Ddownload%26id%3D9886%26viewonline%3D1]– ДЛЯ ОНЛАЙН-ЧТЕНИЯ В СВОБОДНОМ ДОСТУПЕ;