Просмотр содержимого документа
«Кислородсодержащие органические вещества - спирты»

Спирты.
Автор: учитель химии и биологии МАОУ «СОШ №21» г Миасса
Краснокутская Т.Ю.

Содержание
- Определение спиртов
- Классификация спиртов
- Номенклатура и изомерия
- Физические свойства
- Химические свойства
- Способы получения
- Отдельные представители

Спирты. Строение. Физические и химические свойства .
Спиртами (или алканолами ) называются органические вещества , молекулы которых содержат одну или несколько гидроксильных групп (групп-ОН), соединенных с углеводородным радикалом .

У спиртов выделяют три типа классификации:
По количеству гидроксильных групп,
По характеру углеводородного радикала,
По характеру углерода
КЛАССИФИКАЦИЯ СПИРТОВ
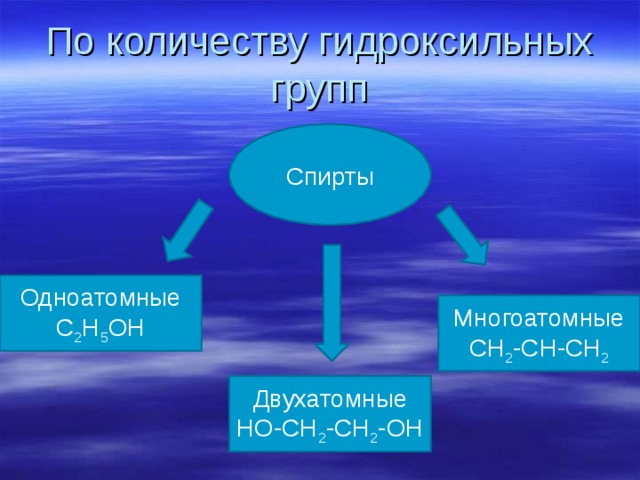
По количеству гидроксильных групп
Спирты
Одноатомные
С 2 Н 5 ОН
Многоатомные
СН 2 -СН-СН 2
Двухатомные
НО-СН 2 -СН 2 -ОН
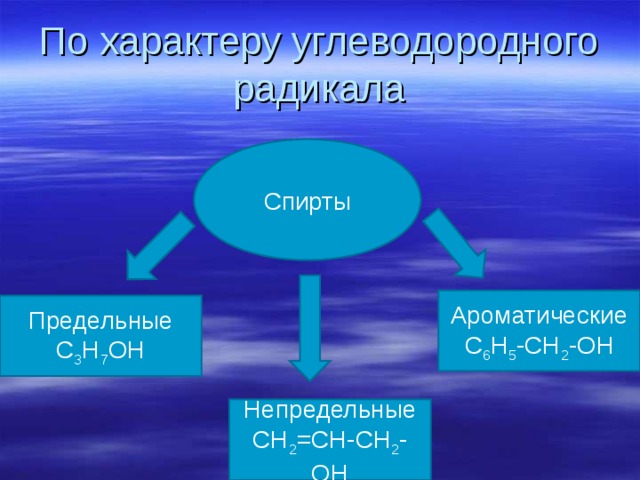
По характеру углеводородного радикала
Спирты
Ароматические
С 6 Н 5 -СН 2 -ОН
Предельные
С 3 Н 7 ОН
Непредельные
СН 2 =СН-СН 2 -ОН
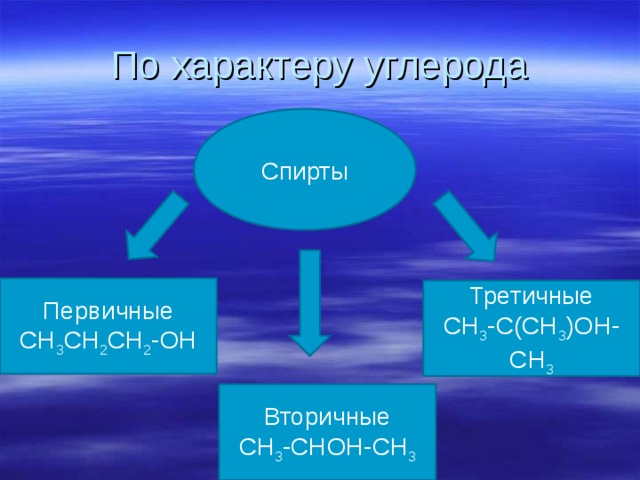
По характеру углерода
Спирты
Первичные
СН 3 СН 2 СН 2 -ОН
Третичные
СН 3 -С(СН 3 )ОН-СН 3
Вторичные
СН 3 -СНОН-СН 3

Номенклатура и изомерия.
- При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют суффикс - ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи :
СН 3 -СН 2 -СН 2 -СН 2 -ОН-бутанол-1
Спирты образуют изомеры : 1) углеродного скелета
СН 3 -СН(СН 3 )-СН 2 -ОН-2-метилпропанол-1
2) положения функциональной группы
СН 3 -СНОН-СН 2 -СН 3 -бутанол-2
3)для них характерна межклассовая изомерия- спирты изомерны простым эфирам
СН 3 -СН 2 -ОН и СН 3 -О-СН 3
Этанол диметиловый эфир

Физические свойства спиртов.
- Между молекулами спиртов возникают водородные связи это приводит к тому, что спирты имеют аномально высокие для своей молекулярной массы температуры кипения. По этой же причине, первые представители спиртов являются жидкостями, а не газами. Высшие спирты(начиная с С 12 Н 25 ОН) при комнатной температуре- твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и октанол уже не смешивается водой.

Химические свойства.
- Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами.
2Na+2C 2 H 5 OH 2C 2 H 5 ONa + H 2
Взаимодействие спиртов с галогеноводородами.
С 2 Н 5 ОН+НВ r C 2 H 5 Br + H 2 O
Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спирта при нагревании в результате образуются простые эфиры.
2С 2 Н 5 ОН С 2 Н 5 -О-С 2 Н 5 + Н 2 О
Внутримолекулярная дегидратация спиртов- в результате образуются алкены.
С 2 Н 5 ОН СН 2 =СН 2 + Н 2 О

- Взаимодействие спиртов с органическими и неорганическими кислотами- образуются сложные эфиры. Реакция называется реакцией этерификации.
- С 2 Н 5 ОН + СН 3 СООН СН 3 СООС 2 Н 5 + Н 2 О
- Спирты окисляются: первичные до альдегидов, а затем до карбоновых кислот; вторичные до кетонов.
- С 2 Н 5 ОН + С uO CH 3 COH + Cu + H 2 O
- Дегидрирование спиртов. При пропускании паров спирта при 200-300 0 С над металлическим катализатором( Cu , Ag , Pt) , первичные спирты превращаются в альдегиды, а вторичные- в кетоны. СН 3 ОН НСОН+ Н 2
- Качественной реакцией на многоатомные спирты является свежеосажденный гидроксид меди( II )- наблюдаем образование ярко-синего раствора.
![Способы получения спиртов. Гидролиз галогеналканов. С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI Гидратация алкенов. СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН Гидрирование альдегидов и кетонов. СН 3 -СОН + Н 2 С 2 Н 5 ОН Окисление алкенов. СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН Специфические способы получения спиртов . Метанол получают в промышленности при взаимодействии водорода с оксидом углерода( II ) при повышенном давлении и высокой температуре в присутствии катализатора. СО+ 2Н 2 СН 3 -ОН Брожение глюкозы. С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2](https://fsd.multiurok.ru/html/2018/02/09/s_5a7e004b2dac6/img11.jpg)
Способы получения спиртов.
С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI
СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН
- Гидрирование альдегидов и кетонов.
СН 3 -СОН + Н 2 С 2 Н 5 ОН
СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН
- Специфические способы получения спиртов .
- Метанол получают в промышленности при взаимодействии водорода с оксидом углерода( II ) при повышенном давлении и высокой температуре в присутствии катализатора.
СО+ 2Н 2 СН 3 -ОН
С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2
Отдельные представители спиртов и их значение.
- Метанол(метиловый спирт СН 3 ОН ) – бесцветная жидкость с характерным запахом, горит голубоватым пламенем. Историческое название метанола- древесный спирт- объясняется одним из способов его получения- перегонкой твердых пород дерева. Метанол очень ядовит! Попадание в организм более 50 мл метанола вызывает смерть. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывая гибель зрительного нерва и полную слепоту.
- Этанол(этиловый спиртС 2 Н 5 ОН )- бесцветная жидкость с характерным запахом, хорошо растворяется в воде. Небольшие количества этанола при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. В больших количествах этанол угнетает деятельность головного мозга, вызывая нарушение координации движений. При систематическом употреблении этанола приводит к стойкому снижению продуктивности работы головного мозга гибели клеток печени и замене их соединительной тканью- циррозу печени.


















![Способы получения спиртов. Гидролиз галогеналканов. С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI Гидратация алкенов. СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН Гидрирование альдегидов и кетонов. СН 3 -СОН + Н 2 С 2 Н 5 ОН Окисление алкенов. СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН Специфические способы получения спиртов . Метанол получают в промышленности при взаимодействии водорода с оксидом углерода( II ) при повышенном давлении и высокой температуре в присутствии катализатора. СО+ 2Н 2 СН 3 -ОН Брожение глюкозы. С 6 Н 12 О 6 2С 2 Н 5 ОН + 2СО 2](https://fsd.multiurok.ru/html/2018/02/09/s_5a7e004b2dac6/img11.jpg)


















