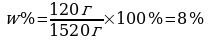Урок №33.
Предмет: Химия
8 класс
Учитель: Воронько Ю.В.
Тема: Вода — растворитель. Растворимость веществ в воде. Растворы.
Цель урока: рассмотреть воду как универсальный растворитель, дать понятие растворы, растворимость.
Тип урока: усвоение новых знаний.
Формирование УУД
Познавательные УУД: умение работать с различными источниками информации, преобразовывать ее из одной формы в другую, выделять главное в тексте, структурировать учебный материал.
Личностные УУД: потребность в справедливом оценивании своей работы и работы одноклассников.
Регулятивные УУД: умение организовать выполнение заданий учителя. Развитие навыков самооценки и самоанализа.
Коммуникативные УУД: умение строить эффективное взаимодействие с одноклассниками.
| Планируемые результаты |
| Предметные | Метапредметные | Личностные |
| Ученик научится: раскрывать смысл понятий «раствор», «растворение», приводить примеры растворимых, малорастворимых, нерастворимых и веществ подвергающихся гидролизу; называть факторы влияющие на растворимость, применять полученные знания на практике. | Ученик приобретет навык химического эксперимента при строгом соблюдении правил техники безопасности. Ученик научится работать с источниками химической информации, адекватно использовать речевые средства для дискуссии, сравнивать разные точки зрения, делать выводы. | Формирование ответственного отношения к обучению, интереса к науке химии, формирование интеллектуальных умений, рефлексии собственной деятельности. Воспитание чувства само- и взаимоуважения. Развитие сотрудничества при работе в парах и группах. |
Методы:
Основной: проблемно-поисковый (решение проблемных задач);
Дополнительные:
словесные (беседа, диалог);
наглядные (работа с рисунками, схемами);
практические (составление схем, таблиц, поиск информации);
дедуктивные (анализ, применение знаний, обобщение).
Оборудование: учебник, доска.
Оборудование на демонстрационном столе: кристаллизатор, вода в колбе, соль, сахар.
Ход урока.
Организационный этап
II. Проверка Д/З.
Опыт 1.
В пробирку с водой добавить кусочек натрия.
Наблюдение признаков реакции.
Добавить несколько капель раствора индикатора.
Наблюдение изменения окраски раствора.
- Записать уравнение реакции на доске и уравнять.
- Определить тип реакции, дать определение.
- Объяснить изменение окраски индикатора.
III. Подготовка к изучению нового материала.
Актуализация опорных знаний
« Вода, у тебя нет ни вкуса,
ни цвета, ни запаха,
тобой наслаждаются,
не ведая, что ты такое.
Нельзя сказать, что ты необходима для жизни:
ты – сама жизнь…»
Сделайте выводы, по этому высказыванию и выскажите своё мнение. (Ответы учащихся)
2. Мотивация
Мы с вами приступаем к изучению нового раздела химии. Чтобы догадаться, о чем сегодняшний урок, отгадайте загадку:
В морях и реках обитает,
Но часто по небу летает.
А как наскучит ей летать,
На землю падает опять.(вода)
3. Сообщение темы и целей урока
Прослушайте стихотворение:
Как-то утром я проспал.
в школу быстро собирался:
Чай холодный наливал,
Сахар всыпал, помешал,
Но не сладким он остался.
Я ещё досыпал ложку,
Стал послаще он немножко.
Чай допил я до остатка,
А в остатке стало сладко
Сахар ждал меня на дне!
Стал прикидывать в уме –
Отчего судьбы немилость?
Виновата – растворимость.
Кто может назвать тему сегодняшнего урока (ответы учащихся):
ТЕМА: «Растворение. Растворимость веществ в воде»
Цели урока:
Дать определение понятию «раствор»
Практическим путем изучить явление растворимости веществ в воде.
Узнать, из каких частей может состоять раствор.
4. Изучение нового материала.
– Как часто мы встречаемся с растворами в жизни? Какие растворы мы знаем? (Моря, реки, океаны; растворы в быту: раствор соли, раствор сахара, раствор стирального порошка и др.; медицинские растворы и т.п.)
– Что является основой большинства известных нам растворов? (Вода)
– Давайте подумаем, как образуется раствор? (карточки у учащихся на партах)
| Вода |
| что добавили | + растительное масло | + речной песок | + поваренная соль (NaCl) | + оксид калия (K2O) |
| Растворение | нет | нет | да | да |
| Химическая реакция | нет | нет | нет | да
K2O + Н2О –– 2КОН |
| Что образовалось | неоднородная система (эмульсия) | неоднородная система (суспензия) | однородная система (раствор) | однородная система (раствор) |
– Где произошло растворение? (В случае с поваренной солью и оксидом калия)
– Где произошла химическая реакция? (В случае с оксидом калия, образовалось новое вещество)
– В чем сходство между образованием смеси (суспензии и эмульсии) с образованием раствора?
– В чем отличие процесса растворения от химической реакцией? (Не образуется новых веществ)
СЛОВО УЧИТЕЛЯ.
Велика роль растворов в возникновении и развитии жизни на Земле. Одной из теорий возникновения организмов является теория зарождения жизни в первичном океане, который представлял собой воду с растворенными в ней веществами. Из этого раствора организмы получали необходимые для роста и развития ионы и молекулы.
В организме человека находятся физиологически важные растворы. Какие?
Различные процессы, происходящие в организме, протекают в растворах. Например, усвоение пищи связано с переводом питательных веществ в раствор.
В природе водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами.
В технике такие процессы, как получение соды, удобрений, бумаги, также протекают в растворах.
Так как растворы играют важную роль в жизни человека, изучение их свойств очень важно.
Что такое раствор и процесс растворения?
Существует несколько теорий растворов.
Представители физической теории растворов развивали такие ученые как Я.Х.Вант-Гофф, С.Аррениус, В.Оствальд. Они считали, что процесс растворения является результатом диффузии, т.е. проникновения растворенного вещества в промежутки между молекулами воды.
Сторонники химической теории, Д.И.Менделеев, И.А.Каблуков, доказывали, что растворение – это результат химического взаимодействия растворенного вещества с молекулами воды.
Доказательством химического взаимодействия служат такие признаки химических реакций как выделение или поглощение тепла при растворении.
Демонстрация
Насыпем небольшое количество медного купороса в пробирку. Отметьте цвет вещества. Нагреем.
Что наблюдаете?
В чем причина изменения цвета?
Растворим в стаканчике с водой небольшое количество сухого сульфата меди (II). Что наблюдаете?
Изменение цвета сульфата меди (II) при растворении его в воде на синий является еще одним доказательством химической теории растворов.
В настоящее время принята теория, объединяющая обе точки зрения – физико-химическая теория Растворение – физико-химический процесс.
Раствор – однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
От чего зависит растворимость веществ в воде?
5. Физминутка
Глубоко вздохнули: вот, мы набрали кислород.
Выдохнув: из легких чистых газ уходит углекислый.
Руки вверх, потом вперед – не поймать нам водород.
Руки в стороны. Ходить. Будем с химией дружить.
6. Закрепление материала.
Факторы, от которых зависит растворимость веществ
Работа с учебником с. 112 От чего зависит растворимость веществ?
- с повышением температуры растворимость твердых веществ возрастает;
- с повышением температуры растворимость газов уменьшается, а с повышением возрастает;
- растворимость газов увеличивается с повышением давления;
- от природы веществ.
Посмотрите в таблицу растворимости и приведите примеры растворимых, малорастворимых и нерастворимых веществ.
Из чего состоит раствор?
По содержанию растворенного вещества выделяют три типа растворов.
Типы растворов
Если растворить в данном объеме воды, например, соль при комнатной температуре, то раствориться может только определенное количество, сколько бы мы не перемешивали раствор с остатком нерастворившейся соли, больше соли не раствориться.
В этом случае говорят, что раствор насыщен этой солью при данной температуре.
Какой образуется раствор, если же при этой температуре в данном объеме воды растворить немного меньшее количество соли?
При осторожном и медленном охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется пересыщенный раствор.
Концентрация растворов
На этикетках разнообразных растворов, используемых в быту, можно прочитать указания в них растворенного вещества. Например, уксусная кислота 70%, настойка йода 5%. Это один из способов выражения концентрации растворов, который называют массовой долей.
Как обозначают массовую долю вещества в растворе?
Данная формула необходима для практического использования при приготовлении и работе с растворами.
Ответ ученика
7. Закрепле-ние изученно-го материала
7.1. Работа в парах
Задачи решаются в парах – 15 мин.
Задача 1. Для того, чтобы обработать цветы, Винни-Пуху нужно приготовить 2 кг.2%-ного раствора нитрата натрия. Помогите ему вычислить массу воды и массу соли, которые ему нужно взять?
Задача 2. Героям этого мультфильма нужно обработать музыкальные инструменты некоторым 20%-ным секретным раствором. У них есть 700 г. этого раствора с концентрацией 45%. Сколько воды им нужно долить, чтобы получить то, что нужно?
Задача 3. Выполните задание тетушки Совы. Вычислите массовую долю раствора, который получится, если 120 г. соли растворить в 1,4 кг. воды.
Задача 1
 Дано: Решение:
Дано: Решение:
m р-ра = 2кг = 2000 г. 
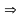
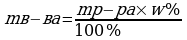
w% = 2% 
___________ m р-ля = m р-ра – m в-ва = 2000г – 40 г.= 1960 г
m в-ва – ?
m р-ля – ? Ответ: m в-ва = 40 г., m р-ля = 1960 г.
Задача 2.
Дано: Решение:
 m р-ра1 = 700 г.
m р-ра1 = 700 г. 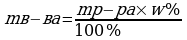
w% = 45% 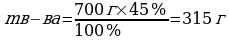
w% р-ра2 = 20% 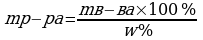
_____________ 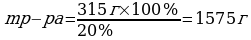
m (H2O) – ? m (H2O) = m р-ра2 – m р-ра1 ; m (H2O) = 1575г – 700г = 875 г
Ответ: m (H2O) = 875 г
Задача 3.
 Дано: Решение:
Дано: Решение:
m в-ва = 120 г. 
m р-ля = 1,4 кг = m р-ра = m в-ва + m р-ля
= 1400 г m р-ра = 120 г. + 1400 г. = 1520г.
____________ 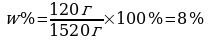
w% – ? Ответ: w% = 8%
7.2. Ответьте на вопросы (для смены видов деятельности)
Что такое раствор?
Что такое растворение?
7.3. Работа у доски и индивидуально.
Решите задачу:
Для консервирования огурцов приготовили рассол: на 2 л воды взяли 200 г соли, а для консервирования томатов приготовили рассол из 200 г соли и 3 л воды. Какой рассол получится более концентрированным?
Ответы учащихся
(Раствор – однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Растворение – физико-химический процесс.
1.40 г
2.20 г)
Решают задачу:
Дано:
V(H2O)2 = 2 л
m (соли1) = 100 г
V(H2O)2 = 3 л
m (соли2) = 100 г
ω1 - ?
ω2 - ?
Решение:
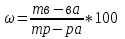
1. Найдем массу первого раствора
m (р-ра1) = m (соли1) + m(H2O)1 = 200 г + 2000 г = 2200 г
2. Определим массовую долю растворенного вещества в первом растворе.
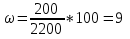
3. Найдем массу второго раствора
m (р-ра2) = m (соли2) + m(H2O)2 = 200 г + 3000 г = 3200 г
4. Определим массовую долю растворенного вещества во втором растворе.
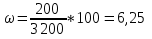
5. ω1 ˃ ω2, первый раствор более концентрированный.
Ответ: рассол для консервирования огурцов более концентрированный.
8. Домашнее задание
33, упр. 1-5, тесты с.113
9. Рефлексия
Предлагаю вспомнить тему и задачи урока и оценить успехи класса в целом и меру своего личного продвижения к цели.
Поднимите сигнальные карточки, если вы ставите за урок:
5 - Зеленую.
4 - Зеленую и красную одновременно.
3- Красную.
2 - Не поднимать карточки.
10. Итоги урока.






 Дано: Решение:
Дано: Решение:
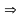
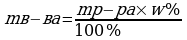

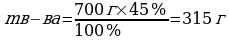
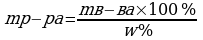
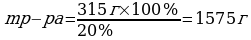
 Дано: Решение:
Дано: Решение: