Тема урока
Алканы .

План .
- Определение . Общая формула класса углеводородов .
- Гомологический ряд .
- Виды изомерии .
- Строение алканов .
- Физические свойства .
- Способы получения .
- Химические свойства .
- Применение .

Алканы . ( Предельные углеводороды . Парафины . Насыщенные углеводороды . )
Алканы - углеводороды в молекулах которых все атомы углерода связаны одинарными связями ( σ -) и имеют общую формулу :
C n H 2n+2

Гомологический ряд метана
Гомологи – это вещества , сходные по строению и свойствам
и отличающиеся на одну или более групп С H 2 .
- СН 4 мет ан
- С 2 H 6 эт ан
- C 3 H 8 проп ан
- C 4 H 10 бут ан
- C 5 H 12 пент ан
- C 6 H 14 гекс ан
- C 7 H 16 гепт ан
- C 8 H 18 окт ан
- C 9 H 20 нон ан
- C 10 H 22 дек ан
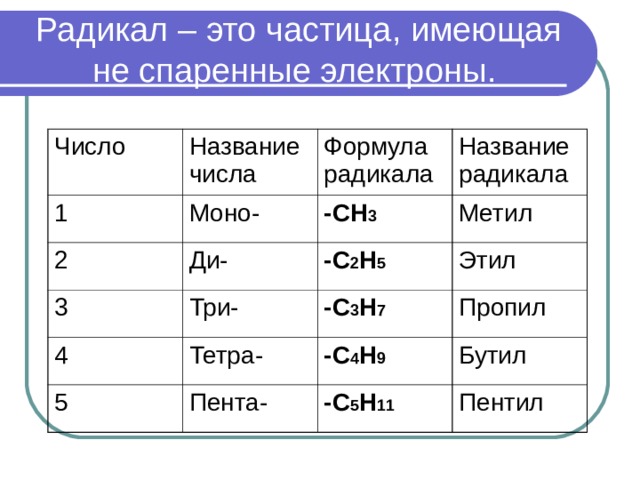
Радикал – это частица , имеющая не спаренные электроны .
Число
Название числа
1
Моно-
Формула радикала
2
Название радикала
-СН 3
Ди-
3
Три-
Метил
-С 2 Н 5
4
5
Тетра-
Этил
-С 3 Н 7
Пропил
Пента-
-С 4 Н 9
Бутил
-С 5 Н 11
Пентил
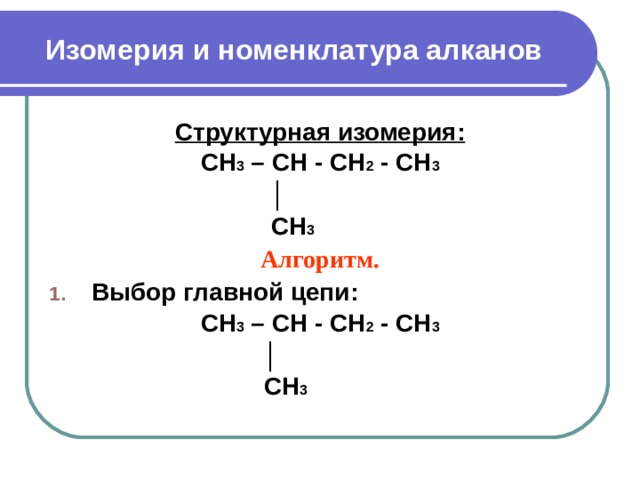
Изомерия и номенклатура алканов
Структурная изомерия :
CH 3 – CH - CH 2 - CH 3
│
CH 3
Алгоритм .
CH 3 – CH - CH 2 - CH 3
│
CH 3
Изомерия и номенклатура алканов
2 . Нумерация атомов главной цепи :
1 2 3 4
CH 3 – CH - CH 2 - CH 3
│
CH 3
Изомерия и номенклатура алканов
3 . Формирование названия :
1 2 3 4
CH 3 – CH - CH 2 - CH 3
│
CH 3
2 - метилбутан
Строение метана
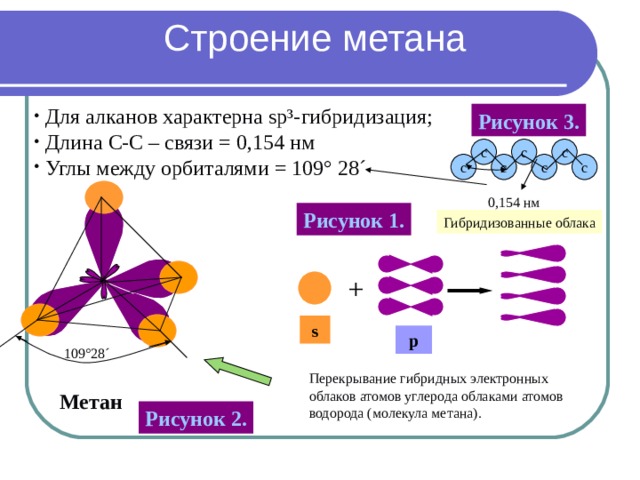
- Для алканов характерна sp ³- гибридизация ;
- Длина С-С – связи = 0 ,154 нм
- Углы между орбиталями = 109 ° 28 ´
Рисунок 3.
c
c
c
c
c
c
c
0 ,154 нм
Рисунок 1 .
Гибридизованные облака
+
s
р
109 °28´
Перекрывание гибридных электронных
облаков атомов углерода облаками атомов
водорода (молекула метана) .
Метан
Рисунок 2 .

Строение гомологов метана
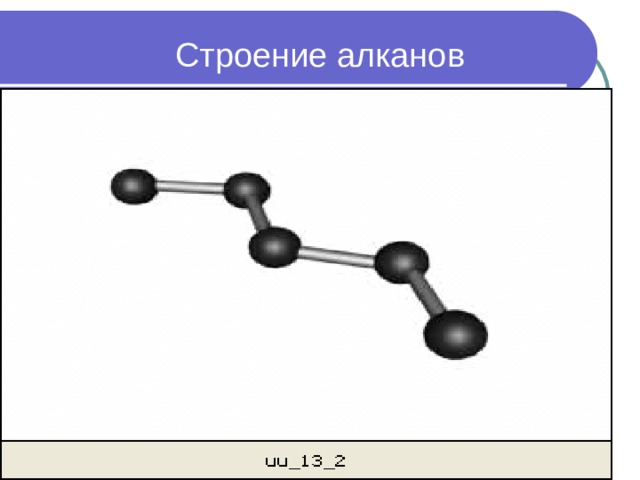
Строение алканов

Строение алканов
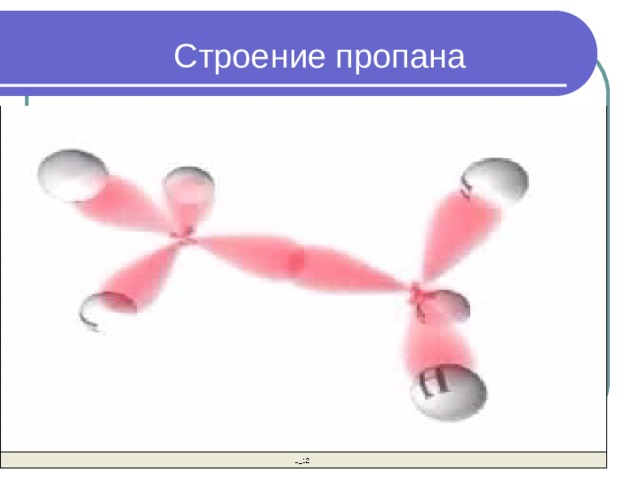
Строение пропана

Физические свойства
СН 4 …C 4 Н 10 – газы
T кипения :
-161,6…-0,5 °C
T плавления :
-182,5…-138,3 °C
С 16 Н 3 4 … и далее– твёрдые вещества
T кипения :
287 ,5 °C
T плавления :
20 °C
С 5 Н 12 …C 15 Н 32 – жидкости
T кипения :
36 , 1 … 270 ,5 °C
T плавления :
-12 9 , 8 … 10 °C
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.

Получение
а) крекинг нефтепродуктов :
C 16 H 34 → C 8 H 18 + C 8 H 16
2) В лаборатории :
а) Гидролиз карбидов :
Al 4 C 3 +12 H 2 O = 3 CH 4 + 4 Al(OH) 3 ↓
б) Реакция Вюрца :
C 2 H 5 Cl + 2Na → C 4 H 10 + 2NaCl
в) Декарбоксилирование натриевых солей карбоновых солей :
СН 3 СОО Na + 2Na ОН → СН 4 ↑ + N а 2 СО 3

Получение метана
Химические свойства алканов
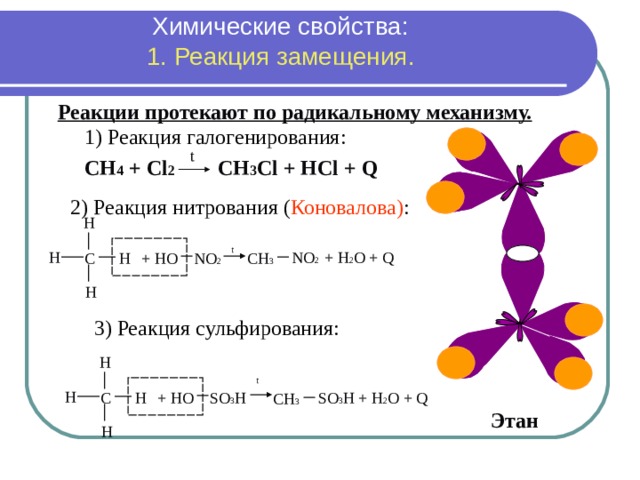
Химические свойства : 1. Реакция замещения .
Реакции протекают по радикальному механизму.
1) Реакция галогенирования :
t
СН 4 + С l 2 CH 3 Cl + HCl + Q
2) Реакция нитрования ( Коновалова) :
б) Нитрование
Н
t
NO 2
+ H 2 O + Q
Н
+ НО NO 2
СН 3
С Н
Н
в) Сульфирование
3) Реакция сульфирования :
Н
t
Н
SO 3 H
+ H 2 O + Q
С Н
+ НО SO 3 H
СН 3
Этан
Н

t , катализатор
СН 3 СН 2 СН 2 СН 2 СН 3
СН 3 СН СН 2 СН 3
СН 3
800 ° С
СН 4 + Н 2 О СО + 3Н 2
синтез-газ
1500 ° С
2СН 4 Н С ≡ С Н + 3Н 2 + Q
СН 3 СН 3 Н 2 С=СН 2 + Н 2 + Q
Предельные углеводороды горят (пламя не коптящее )
3СО 2 + 4Н 2 О + Q
С 3 Н 8 + 5О 2
В присутствии катализаторов окисляются:
О
500 ° С, катализатор
СН 4 + О 2
+ Н 2 О + Q
Н С
Н
2СН 3 (СН 2 ) 34 СН 3 + 5О 2
4СН 3 (СН 2 ) 16 СООН +2Н 2 О + Q

6. Реакция горения : CH 4 + 2O 2 → CO 2 + 2H 2 O + Q

Применение алканов
Широко
используются в
качестве
топлива, в том
числе для
двигателей
внутреннего
сгорания.

Применение алканов
1-3 – производство сажи
(1 – картрижи ;
2 – резина ;
3 – типографическая краска)
4-7 – получение
органических веществ
(4 – растворителей ;
5 – хладогентов ,
используемых
в холодильных установках ;
6 – метанол ;
7 - ацетилен)

Закрепление .
- Составьте все возможные изомеры для гептана и назовите их .
- Составьте 2 ближайших гомолога для пентана и назовите их .
- Определить предельный углеводород , плотность паров которого по воздуху равна 2 .
- Учебник : №12 (стр . 33 )

Домашнее задание
- Учебник О . С . Габриелян
(10 класс базовый уровень)
- § 3 , упр . 4 , 7 , 8 ( стр . 32 )