Просмотр содержимого документа
«Урок по теме "Основания"»

Основания
Химия
8 класс
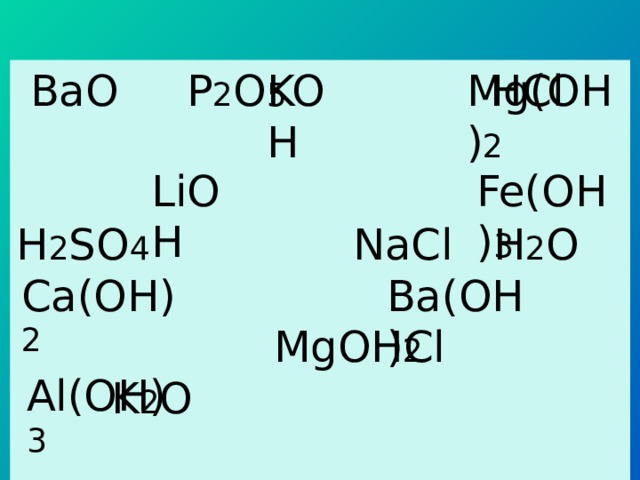
BaO P 2 O 5 HCl
H 2 SO 4 NaCl H 2 O
MgOHCl K 2 O
NO AgNO 3 CaO Al 2 O 3
KOH
Mg(OH) 2
LiOH
Fe(OH) 3
Ca(OH) 2
Ba(OH) 2
Al(OH) 3

Определение оснований
Ме( ОН ) n
Гидроксиды
К ОН Ca ( ОН ) 2 Al ( ОН ) 3 Ba ( ОН ) 2
K OH K +1 + OH -1
Ba (ОН) 2 Ba +2 + 2 OH -1
Основания – вещества, в растворах которых содержатся гидроксильные ионы

Названия оснований
гидроксид
гидроксид
гидроксид
гидроксид
гидроксид
гидроксид
калия
КОН
Mg(OH) 2
LiOH
Fe(OH) 3
Ca(OH) 2
Al(OH) 3
магния
лития
железа
(III)
кальция
алюминия
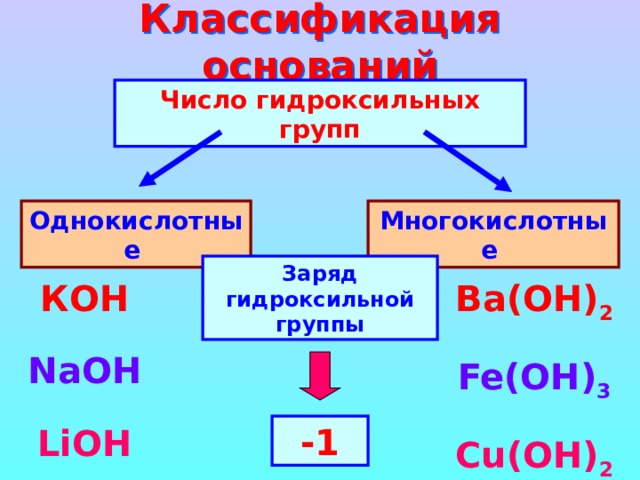
Классификация оснований
Число гидроксильных групп
Однокислотные
Многокислотные
Заряд гидроксильной группы
КОН
Ba( ОН ) 2
Fe(OH) 3
NaOH
Cu(OH) 2
LiOH
-1
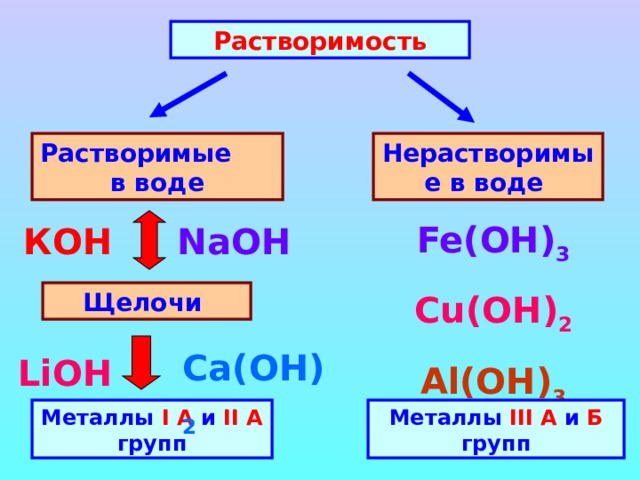
Растворимость
Растворимые в воде
Нерастворимые в воде
Fe(OH) 3
Cu(OH) 2
Al (ОН) 3
КОН
NaOH
Щелочи
Ca (ОН) 2
LiOH
Металлы I А и II А групп
Металлы III А и Б групп

Сильные и слабые основания
Сильные основания
Слабые основания
NaOH гидроксид натрия (едкий натр)
KOH гидроксид калия (едкое кали)
LiOH гидроксид лития
Ba(OH) 2 гидроксид бария
Ca(OH) 2 гидроксид кальция
Mg(OH) 2 гидроксид магния
Fe(OH) 2 гидроксид железа (II)
Zn(OH) 2 гидроксид цинка
NH 4 OH гидроксид аммония
Fe(OH) 3 гидроксид железа (III)
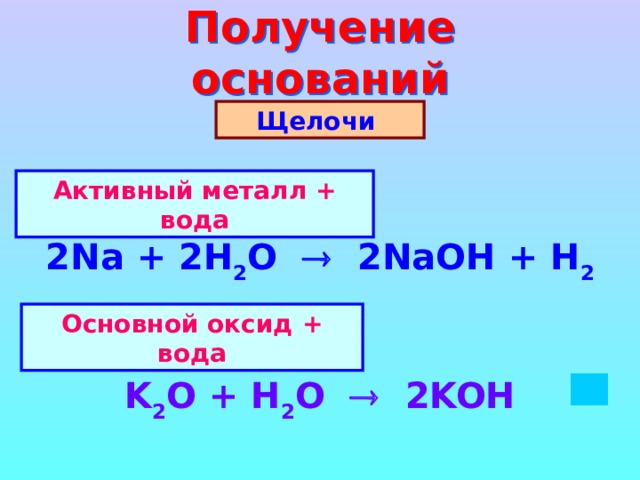
Получение оснований
Щелочи
Активный металл + вода
2Na + 2H 2 O 2NaOH + H 2
Основной оксид + вода
K 2 O + H 2 O 2KOH
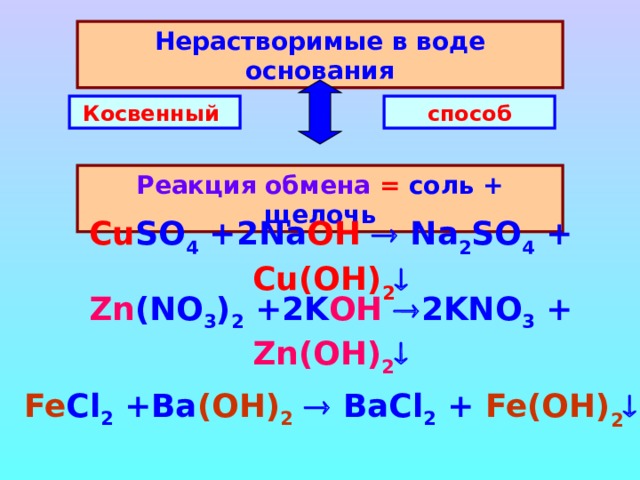
Нерастворимые в воде основания
Косвенный
способ
Реакция обмена = соль + щелочь
Cu SO 4 +2Na OH Na 2 SO 4 + Cu(OH) 2
Zn (NO 3 ) 2 +2 K OH 2KNO 3 + Zn (OH) 2
Fe Cl 2 + Ba ( OH ) 2 BaCl 2 + Fe (OH) 2

Физические свойства оснований
Ba(OH) 2
Ca(OH) 2
LiOH
Co(OH) 2
NaOH
Cu(OH) 2
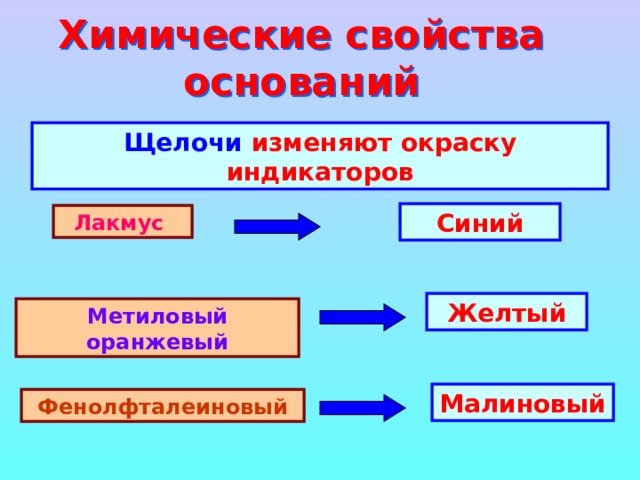
Химические свойства оснований
Щелочи изменяют окраску индикаторов
Синий
Лакмус
Желтый
Метиловый оранжевый
Малиновый
Фенолфталеиновый
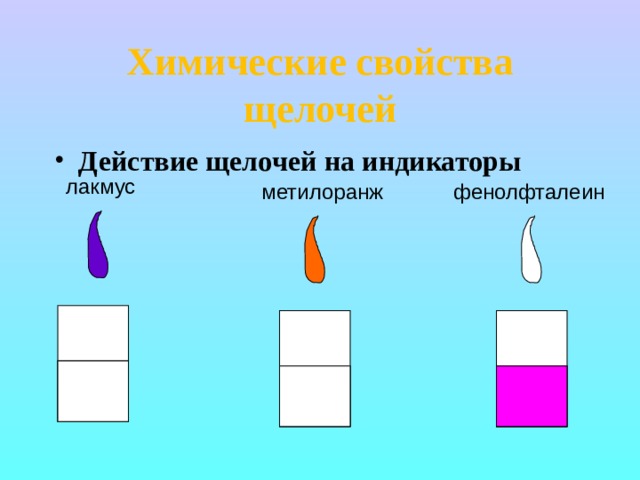
Химические свойства щелочей
- Действие щелочей на индикаторы
лакмус
метилоранж
фенолфталеин
 7 " width="640"
7 " width="640"
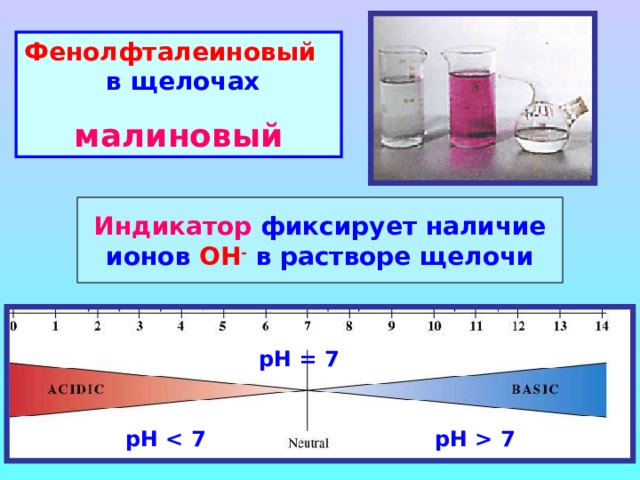
Фенолфталеиновый в щелочах
малиновый
Индикатор фиксирует наличие ионов ОН - в растворе щелочи
рН = 7
рН 7
рН 7
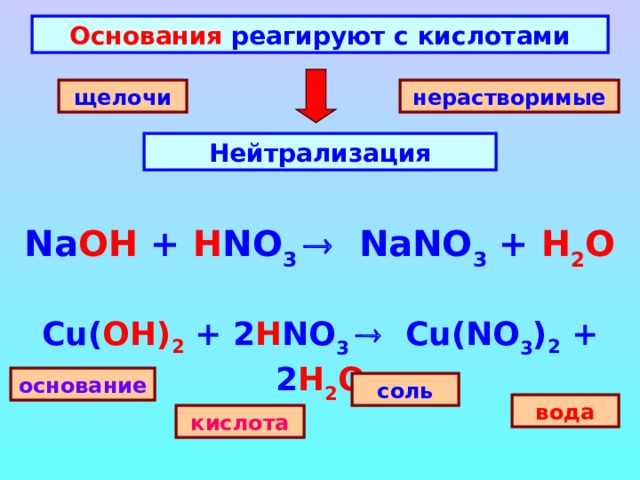
Основания реагируют с кислотами
нерастворимые
щелочи
Нейтрализация
Na OH + H NO 3 NaNO 3 + H 2 O
Cu( OH ) 2 + 2 H NO 3 Cu( NO 3 ) 2 + 2 H 2 O
основание
соль
вода
кислота

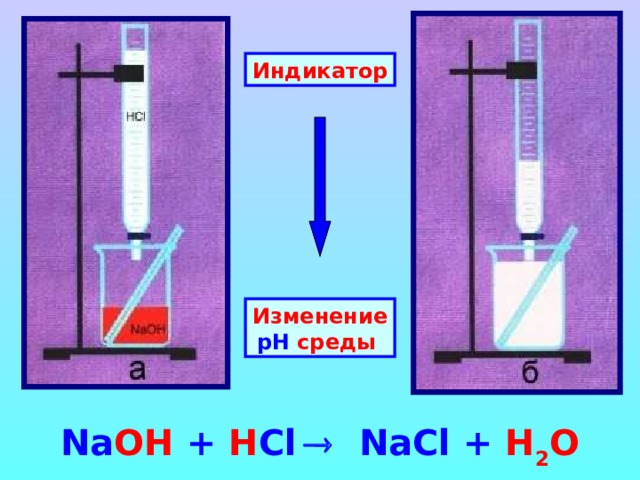
Индикатор
Изменение рН среды
Na OH + H Cl Na Cl + H 2 O
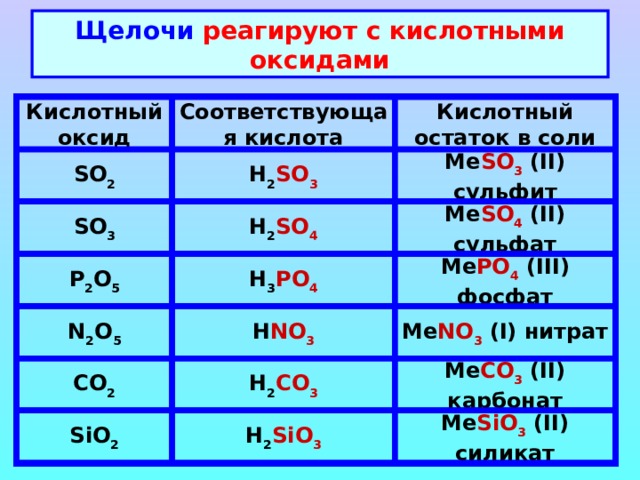
Щелочи реагируют с кислотными оксидами
Кислотный оксид
Соответствующая кислота
Кислотный остаток в соли
SO 2
H 2 SO 3
Me SO 3 (II) сульфит
SO 3
H 2 SO 4
Me SO 4 (II) сульфат
Me PO 4 (III) фосфат
H 3 PO 4
P 2 O 5
N 2 O 5
H NO 3
Me NO 3 (I) нитрат
Me CO 3 (II) карбонат
CO 2
H 2 CO 3
SiO 2
H 2 SiO 3
Me SiO 3 (II) силикат
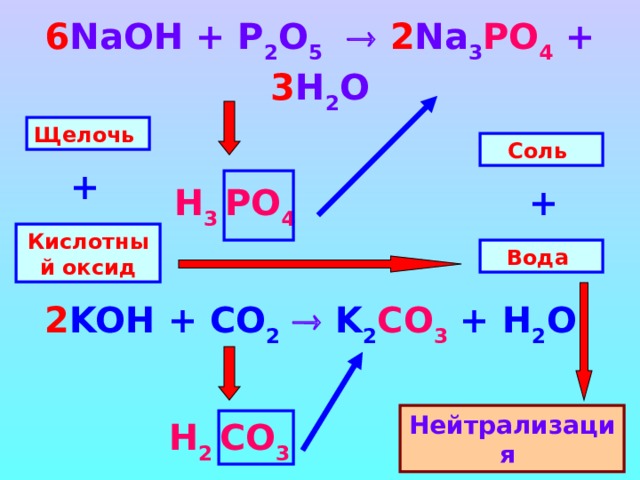
6 NaOH + P 2 O 5 2 Na 3 PO 4 + 3 H 2 O
Щелочь
Соль
+
+
Н 3 PO 4
Кислотный оксид
Вода
2 KOH + CO 2 K 2 CO 3 + H 2 O
Нейтрализация
Н 2 CO 3
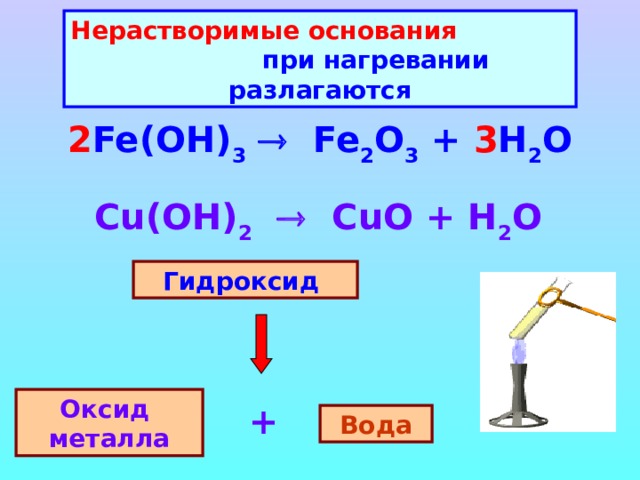
Нерастворимые основания при нагревании разлагаются
2 Fe(OH) 3 Fe 2 O 3 + 3 H 2 O
Cu(OH) 2 CuO + H 2 O
Гидроксид
Оксид металла
+
Вода
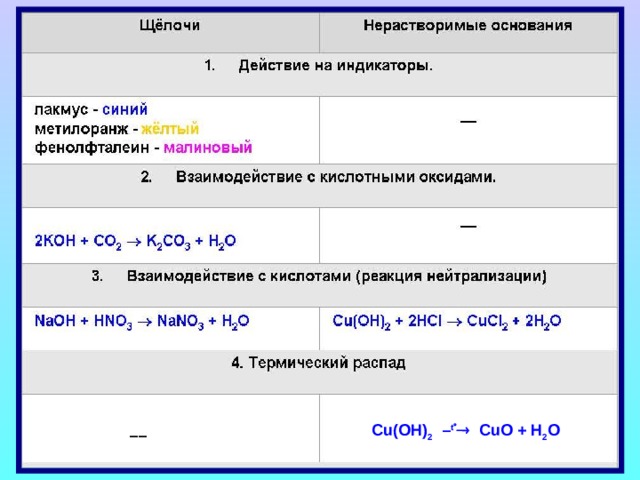
Cu(OH) 2 – t CuO + H 2 O
––

Источники информации:
- http://www.alhimik.ru/teleclass/pictures/flasks1.jpg
- http://www.logosib.ru/him/NaOH.jpg
- http://www.chemistryland.com/CHM151S/04-Solutions/acids/LyeWatchGlass.jpg
- http://i00.i.aliimg.com/photo/v0/532800286/_font_b_barium_b_font_font.summ.jpg
- http://www.ru.all.biz/img/ru/catalog/small/717183.jpeg
- http://s005.radikal.ru/i210/1105/31/d0b7af03051c.jpg
- http://upload.wikimedia.org/wikipedia/commons/6/6e/Calcium_hydroxide.jpg
- http://ppt4web.ru/khimija


















 7 " width="640"
7 " width="640"


























