
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.

Цель урока : 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки). 2.Обобщить и расширить знания о физических свойствах металлов и их классификаций. 3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.

МЕДЬ
Иду на мелкую монету, В колоколах люблю звенеть, Мне ставят памятник за это И знают: имя мое-….

ЖЕЛЕЗО
Пахать и строить - все он может, если ему уголек в том поможет…

Металлы – это группа веществ с общими свойствами.
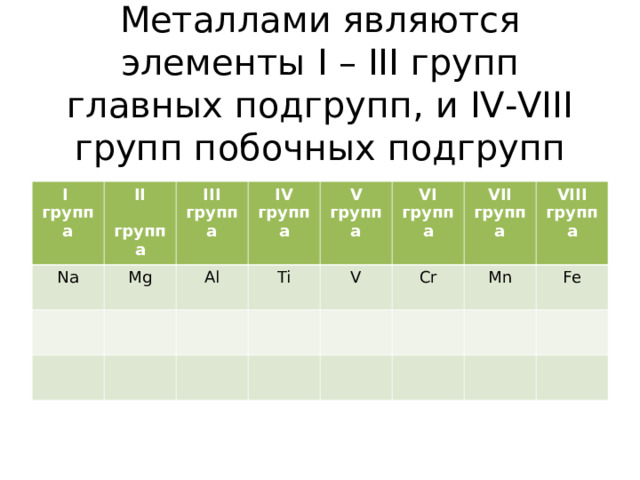
Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп
I группа
Na
II группа
Mg
III группа
IV группа
Al
Ti
V группа
VI группа
V
Cr
VII группа
VIII группа
Mn
Fe
Задание. Самостоятельно в тетради допишите представителей групп, являющиеся металлами.
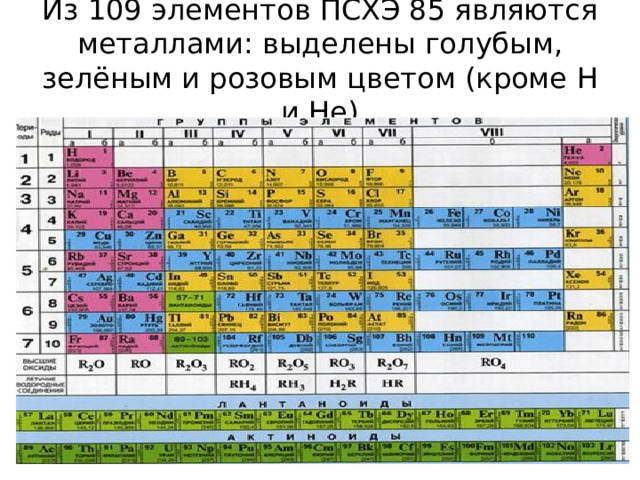
Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He )

Положение элемента в ПС отражает строение его атомов
ПОЛОЖЕНИЕ ЭЛЕМЕНТА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
СТРОЕНИЕ ЕГО АТОМОВ
Порядковый номер элемента в периодической системе
- Заряд ядра атома
- Общее число электронов
Номер группы
- Число электронов на внешнем энергетическом уровне.
- Высшая валентность элемента, степень окисления
Номер периода
- Число энергетических уровней.
- Число подуровней на внешнем энергетическом уровне
Запишите в тетради данную инструкцию об анализе элемента по положению в ПС.

Модель атома натрия
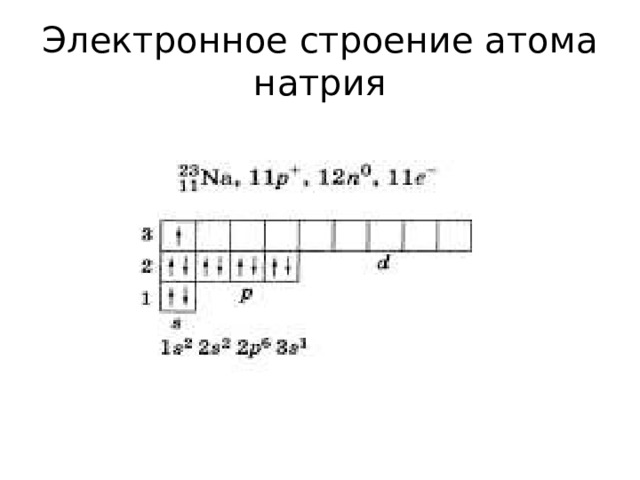
Электронное строение атома натрия

Задание 2. Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно по примеру с атомом натрия.

Вывод: 1. Металлы – элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже 4-6. 2. Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.

Металлическая химическая связь характеризуется: - делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно связывают множество ядер; - валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален; - металлическая связь не обладает направленностью и насыщенностью.
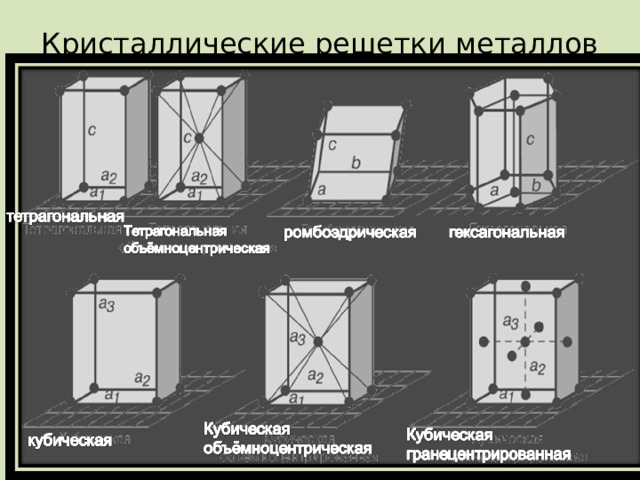
Кристаллические решетки металлов

Видеоинформация о кристаллах металлов

Свойства металлов определяются строением их атомов.
Свойство металла
Характеристика свойства
твердость
Все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
плотность
Металлы делятся на лёгкие (плотность 5г/см) и тяжелые (плотность больше 5г/см).
плавкость
Металлы делятся на легкоплавкие и тугоплавкие
электропроводность, теплопроводность
Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
металлический блеск
Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло
пластичность .
Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.

Проверьте усвоение знаний на уроке тестированием
1) Электронная формула кальция.
А) 1S 2 2S 2 2Р 6 3S 1
Б) 1S 2 2S 2 2 Р 6 3 S 2
В) 1S 2 2S 2 2 Р 6 3 S 2 3S 6 4S 1
Г) 1S 2 2S 2 2 Р 6 3 S 2 3 Р 6 4 S 2

Задания теста 2 и 3
2) Электронную формулу 1S 2 2S 2 2Р 6 3S 2 3Р 6 4S 2 имеет атом:
а) Nа
б) Са
в) Сu
г) Zn
3) Электропроводность, металлический блеск, пластичность, плотность металлов определяются :
а) массой атомов
б) температурой плавления металлов
в) строением атомов металлов
г) наличием неспаренных электронов

Задания теста 4 и 5
4) Металлы при взаимодействии с неметаллами проявляют свойства
а) окислительные;
б) восстановительные;
в) и окислительные, и восстановительные;
г) не участвуют в окислительно-восстановительных реакциях;
5) В периодической системе типичные металлы расположены в:
а) верхней части;
б) нижней части;
в) правом верхнем углу;
г) левом нижнем углу;
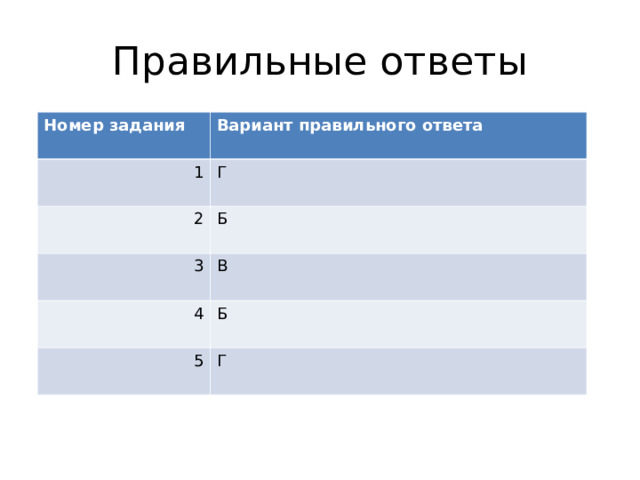
Правильные ответы
Номер задания
Вариант правильного ответа
1
Г
2
Б
3
В
4
Б
5
Г













































