Просмотр содержимого документа
«Углерод 9 класс»

Углерод
Республика Узбекистан
Андижанской области
Города Ханабада СОШ№2
Учитель по химии: Кадирова.М.З
Пригатовил: Шаробидинов.А.Х

«Химическая история»
- Углерод является одним из первых химических элементов, который известен человеку. 3750 г. до н.э.
- Углерод является одним из элементов, имя первооткрывателя которого неизвестно, неизвестно и то, какая из форм элементарного углерода – алмаз или графит – была открыта раньше. И то и другое случилось слишком давно, ещё до возникновения письма.
- В 1791 г. английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод.

«Химическая история»
- Впервые название углерод (carbone) в книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа "Метод химической номенклатуры" (1787) .
- Международное название Carboneum происходит от лат. carbo (уголь).
- Соединения углерода имеют в названии часть карб(он) - от лат. carbō (род. п. carbōnis ) «уголь».
![Основные характеристики Имя, : Углерод / Carboneum Символ, номер:(С) , 6 Электронная конфигурация: [He] 2s 2 2p 2 Температура кипения: 4 827°C Атомная масса: 12,0107 ± 0,0008 а. е. м. Степень окисления -4 , +2, +4](https://fsd.multiurok.ru/html/2022/10/25/s_6357ff79ec7b2/img3.jpg)
Основные характеристики
- Имя, : Углерод / Carboneum
- Символ, номер:(С) , 6
- Электронная конфигурация: [He] 2s 2 2p 2
- Температура кипения: 4 827°C
- Атомная масса: 12,0107 ± 0,0008 а. е. м.
- Степень окисления -4 , +2, +4

Содержание углерода:
В земной коре
45%
В растительной клетке,
0,27%
В человеческом
организме
18%
10,5%
В животной клетке

Физические свойства
- Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами.
- Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
- Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит

Аллотр о пия - (от греч. állos — другой и trópos — поворот, свойство), существование одного и того же химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам.

Исходя из строения атома, прогнозируют окислительно-восстановительные свойства углерода:

Аллотропные модификации углерода
Прочитать текст в учебнике на стр. 164-167 и заполнить таблицу.
Признаки сравнения
Алмаз
Кристаллическая решетка
Графит
Физические свойства
Применение

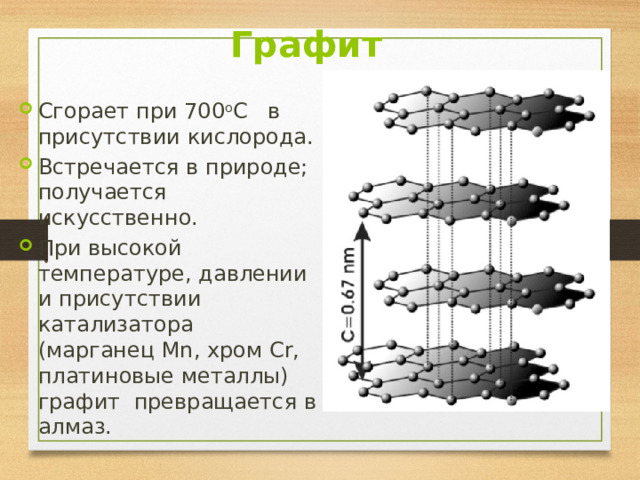
Графит
- Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью
- Атомы расположены параллельными слоями, образуя гексагональную решетку.
- Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться
Графит
- Сгорает при 700 о С в присутствии кислорода.
- Встречается в природе; получается искусственно.
- При высокой температуре, давлении и присутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз.

Алмаз
- Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет.
- Не проводит электрический ток, но имеет высокую теплопроводность.
- В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей.

Алмаз
- Алмаз - это самое твердое вещество из всех известных.
- Температура плавления выше 3500 о С. Химически стоек. Сгорает при 870 о С в присутствии кислорода. При 1800 о С в отсутствие кислорода превращается в графит
Прозрачные кристаллы; после обработки - бриллианты.
Добывают из россыпей и коренных месторождений. Синтетический алмаз получают из графита при высоком давлении и температуре.

Карбин
- Карбин получен искусственно.
- Он представляет собой мелкокристаллический порошок чёрного цвета.
- Построен из длинных цепочек атомов С, уложенных параллельно друг другу.

Лонсдейлит
- Лонсдейлит найден в метеоритах и получен искусственно;
- Его структура и свойства окончательно не установлены

Адсорбция
Активированный уголь
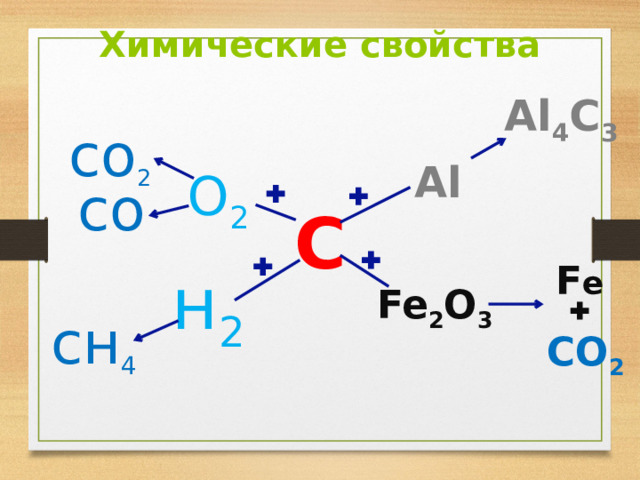
Химические свойства
Al 4 C 3
со 2
Al
О 2
со
С
F e
н 2
Fe 2 O 3
сн 4
CО 2

Применение углерода С
- Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
- В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)

Применение углерода С
- Графит используется в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости.
- Также его используют в качестве смазки при особо высоких или низких температурах.
- Его невероятно высокая температура плавления, позволяет делать из него тигли для заливки металлов.
- Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.

Применение углерода С
- Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин.
- Кроме этого, ограненные алмазы - бриллианты используются в качестве драгоценных камней в ювелирных украшениях.
- Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров

Применение углерода С
- В фармакологии и медицине широко используются различные соединения углерода.
- Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний


Круговорот углерода в природе
- Углерод является основой всех органических веществ.
- Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни.
- Источником углерода для живых организмов обычно является СО 2 из атмосферы или воды.
- В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела.
- Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.


Круговорот углерода в природе
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.

Тест «Углерод»
- Атом углерода расположен в:
а) VI группе главной подгруппе;
б) V группе побочной подгруппе;
в) IV группе побочной подгруппе;
г) IV группе главной подгруппе.
2. Углерод не проявляет степень окисления:
а)+4; б)+5; в)-4; г)+2.
3. Степень окисления углерода - 4 в соединении:
а) СН 4 ;
б) СО;
в) ССl 4 ;
г)Н 2 С0 3 .

4.Углерод проявляет свойства:
а) только окислительные;
б) только восстановительные;
в) окислительные и восстановительные.
5.Кристаллическая решётка в простых веществах углерода:
а) ионная;
б) молекулярная,
в) атомная;
г) металлическая.

6.Самое твёрдое вещество:
а) графит;
б) карбин;
в) фуллерен;
г) алмаз.
7. Не имеет кристаллического строения:
а) кокс;
б) алмаз;
в) графит;
г) карбин.

Домашние задание
§ 29. упр. 5,8* (письменно).









![Основные характеристики Имя, : Углерод / Carboneum Символ, номер:(С) , 6 Электронная конфигурация: [He] 2s 2 2p 2 Температура кипения: 4 827°C Атомная масса: 12,0107 ± 0,0008 а. е. м. Степень окисления -4 , +2, +4](https://fsd.multiurok.ru/html/2022/10/25/s_6357ff79ec7b2/img3.jpg)











































