
Химия 8 класс
Типы химических реакций.
Реакции замещения и обмена.
Н. Бозаджи,
учитель химии ,
высшая дидактическая категория

В результате изучения темы урока вы будете способны :
- о перирова ть в различных ситуациях общения понятиями : реакция замещения, обмена;
- читать химические уравнения, комментировать роль веществ (исходное вещество / реагент, продукт реакции / полученное вещество), тип реакции, определять коэффициенты.

Химические реакции - это реакции, в результате которых изменяется состав веществ , т.е. из одних веществ образуются другие, новые вещества.
www.Google.com

Вспомним
Признаки химических реакций
Ц
В
З
Г
Т
О
Изменение ц вета
Изменение в куса
Появление или исчезновение з апаха
Выделение г аза
Выделение или поглощение т епла
Образование или исчезновение о садка
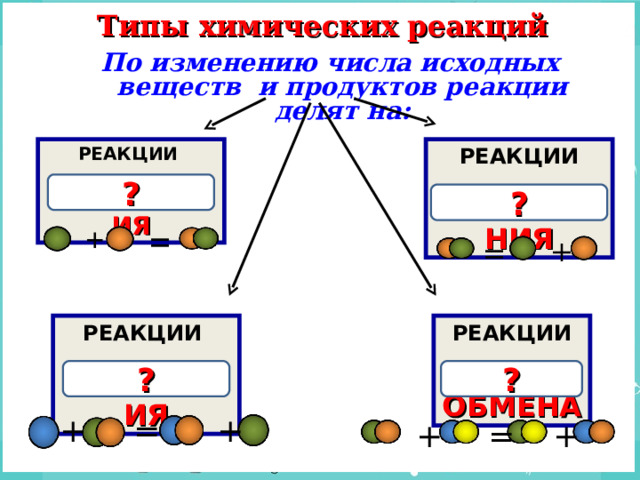
Типы химических реакций
По изменению числа исходных веществ и продуктов реакции делят на:
РЕАКЦИИ
РЕАКЦИИ
РАЗЛОЖЕНИЯ
СОЕДИНЕНИЯ
?
?
+
=
+
=
РЕАКЦИИ
ОБМЕНА
РЕАКЦИИ
ЗАМЕЩЕНИЯ
?
?
+
=
+
=
+
+

Реакция замещения
- это реакция между простым и сложным веществом , в результате которой атомы простого вещества замещают атомы одного из с элементов сложного вещества.
Попробуйте сформулировать определение.
Между какими веществами происходит реакция?
+
+
=
А + В С = А С + В

Взаимодействие Zn с H С l

Составим уравнение реакции:
+ 2
-
2
2
Zn + HCl ZnCl + H 2
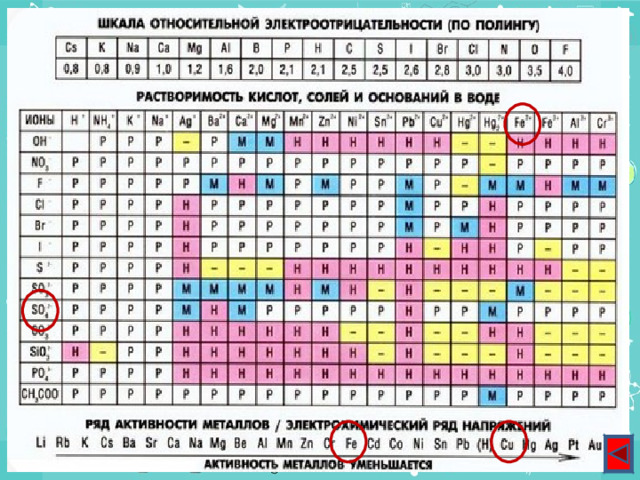
Таблица растворимости
Признак реакции?
Выделение газа!


Взаимодействие Fe с CuSO 4

Составим уравнение реакции:
+ 2
-2
Cu
Fe + Cu SO 4 Fe SO 4 +
═
Таблица растворимости
Признак реакции?
Изменение цвета!

Закрепим материал
Из предложенных реакций выберите
реакции замещения .
1) CaO + CO 2 = CaCO 3
2) Zn + 2HCl = ZnCl 2 + H 2 ↑
3) 2H 2 O = 2H 2 ↑ + O 2 ↑
4) CuO + H 2 = Cu + H 2 O
5) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O

Реакции обмена
- это реакции между двумя сложными веществами , в результате которых они обмениваются своими составными частями .
+
=
+
АВ + С D = А D + С В

Взаимодействие CuSO 4 с NaOH
https://www.youtube.com/watch?v=QWk2Hl5_1Gg

Составим уравнение реакции:
+2
-
2
- 2
+
═
Cu SO 4 + Na OН + Na SO 4
2
C u OН
C u (OН )
2
Таблица растворимости
Признак реакции?
Выпадение осадка!


Закрепим материал
Из предложенных реакций выберите
реакции обмена .
- ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
2) CuSO 4 + Fe = Cu + FeSO 4
4) H 2 SO 4 + 2 K OH = K 2 SO 4 + 2Н 2 O
5) BaO + SO 2 = BaSO 3

Если вас заинтересовала тема урока, предлагаем выполнить упражнение:
Определите тип химической реакции и расставьте коэффициенты, где это необходимо .
Li + H 2 O = LiOH + H 2
Cu(OH) 2 + HCl = CuCl 2 + H 2 O
AgNO 3 + HCl = AgCl + HNO 3
Fe 2 O 3 + H 2 = Fe + H 2 O

Домашнее задание
- § 2.4.3, стр.32
- конспект, PPT
- упр.работа в группе:
1 столбик стр.25

Использованные ресурсы
№
Ресурс
1
Источник ресурса
Основы Национального Куррикулума
2
https://mecc.gov.md/sites/default/files/cadrul_de_referinta_final_rus_tipar.pdf
Куррикулум по химии
3
https://mecc.gov.md/sites/default/files/c-chimiagimnaziuru.pdf
Гид по внедрению куррикулума-2019
4
5
https://mecc.gov.md/sites/default/files/ghid-chimiagimnaziuru.pdf
Modele de proiecte didactice de lungă durată
https://mecc.gov.md/sites/default/files/chimie_cl._vii_2019-2020_final.pdf
Методологические ориентиры по организации учебного процессa по дисциплине химия в 2019-2020 учебном году
6
https :// mecc . gov . md / sites / default / files /12.1._ chimie _ rus _2019-2020_ final . pdf
Шаблон презентации
7
https://templates.office.com/ru-ru/%d0%9e%d0%b1%d1%80%d0%b0%d0%b7%d0%be%d0%b2%d0%b0%d0%bd%d0%b8%d0%b5?page=3
Материалы презентации
http://www.myshared.ru/slide/556018/











































