Кодификатор элементов содержания тестирования по химии.
11 класс. 2 полугодие.
(5 вариантов)
| № раздела и темы |
Элементы содержания | Соответствие вопросам тестирования | % предполагаемого выполне- ния |
| 1. | ТЕМА 3. Химические реакции |
| 70 – 100 |
| 1.1 | Классификация химических реакций в органической и неорганической химии. | А.1 |
| 1.2 | Скорость химической реакции. | А.2 |
| 1.3 | Обратимость химических реакций. Химическое равновесие и способы его смещения. | А.3 |
| 1.4 | Электролитическая диссоциация. | А.4 |
| 1.5 | Реакции ионного обмена. | А.5 |
| 1.6 | Гидролиз неорганических и органических соединений. Среда водных растворов. | А.6 |
| 1.7 | Окислительно-восстановительные реакции. | А.7 |
| 1.8 | Электролиз. | А.8 |
| 1.9 | Металлы и их свойства. | А.9 |
| 1.10 | Способы получения металлов. Коррозия металлов. | А.10 |
| 1.11 | Неметаллы. | А.11 |
| 1.12 | Кислоты. Основания. | А.12 |
| 1.13 | Соли. Генетическая связь между классами соединений. | А.13 |
| 1.1 | Классификация химических реакций в органической и неорганической химии. | В.1 | 60-80 |
| 1.2 | Скорость химической реакции. | В.2 |
| 1.5 | Реакции ионного обмена. | В.3 |
| 1.6 | Гидролиз неорганических и органических соединений. Среда водных растворов. | В.4 |
| 1.7 | Окислительно-восстановительные реакции. | В.5 |
| 1.8 | Электролиз. | В.6 |
|
| Нахождение молекулярной формулы вещества | С.1 | 10-20 |
А.1. К реакциям гидрирования относится взаимодействие водорода 1 - г
а) кислородом
б) азотом
в) серой
г) пропиленом
А.1. К реакциям замещения относится взаимодействие 1 - а
а) пропана и хлора при овсещении
б) пропена и водорода
в) пропена и хлора при комнатной температуре
г) пропена и воды
А.1. Взаимодействие оксида кальция с водой относится к реакции 1 - а
а) соединения
б) замещения
в) разложения
г) обмена
А.1. Взаимодействие этилена с бромной водой относится к реакции 1 - а
а) соединения
б) замещения
в) разложения
г) обмена
А.1. Взаимодействие нитрата серебра с хлоридом меди относится к реакции 1 - г
а) соединения
б) замещения
в) разложения
г) обмена
А.2. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно 2 - б
а) разбавить кислоту
б) измельчить мрамор
в) добавить индикатор
г) проводить реакцию в атмосфере инертного газа
А.2. С наибольшей скоростью при обычных условиях взаимодействуют 2 - в
а) азот и водород
б) магний и вода
в) раствор гидроксида натрия и соляная кислота
г) сера и железо
А.2. Какой металл реагирует с серной кислотой быстрее других? 2 - б
а) Zn
б) Mg
в) Fe
г) Pb
А.2. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, - это 2 - г
а) нейтрализация серной кислоты раствором гидроксида натрия
б) горение водорода в кислороде
в) взаимодействие растворов хлорида меди и гидроксида калия
г) горение алюминия в кислороде
А.2. При повышении давления увеличивается скорость реакции 2 - а
а) кислорода с сернистым газом
б) цинка с серной кислотой
в) серы с железом
г) гидроксида натрия с хлоридом меди (II)
А.3. Обратимая химическая реакция 3 - а
а) гидролиз сложного эфира
б) горение дров
в) варка мяса
г) затвердевание цемента
А.3. Обратимой реакции соответствует уравнение 3 - б
а) КОН + НС1 = KCI + Н2О
б) N2 + 3Н2 = 2NH3
в) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
г) Na2О + 2HCI = 2NaCl + H2О
А.3. При понижении давления химическое равновесие смещается в сторону 3 - в
а) эндотермической реакции
б) экзотермической реакции
в) уменьшения объема реакционной смеси
г) увеличения объема реакционной смеси
А.3. Состояние химического равновесия характеризуется 3 - б
а) прекращением протекания прямой и обратной химической реакций
б) равенством скоростей прямой и обратной реакций
в) равенством суммарной массы продуктов суммарной массе реагентов
г) равенства суммарного количества вещества продуктов суммарному количеству вещества реагентов
А.3. На смешение химического равновесия в системе N2 + ЗН2 2NH3 + Q
не оказывает влияния 3 - г
а) понижение температуры
б) повышение давления
в) удаление аммиака из зоны реакции
г) применение катализатора
А.4. Среди следующих веществ неэлектролитом является 4 - а
а) оксид серы (IУ)
б) расплав гидроксида натрия
в) раствор хлорида бария
г) азотная кислота
А.4. Слабым электролитом является 4 - в
а) азотная кислота
б) фосфат натрия
в) гидроксид железа (II)
г) хлорид натрия
А.4. Вещества, образующие при диссоциации в качестве анионов только гидроксид-ионы, являются 4 - б
а) кислотами
б) щелочами
в) средними солями
г) кислыми солями
А.4. Реакция между растворами NaOH и HNO3 протекает до конца, так как 4 - а
а) образуется слабый электролит вода
б) гидроксид натрия является щелочью
в) оба вещества являются электролитами
г) образуется растворимый нитрат натрия
А.4. Вещества, образующие при диссоциации в качестве катионов только ионы водорода являются 4 - а
а) кислотами
б) щелочами
в) средними солями
г) кислыми солями
А.5. Какая пара ионов не может одновременно присутствовать в растворе? 5 - б
а) Cu2+ и Cl-
б) Cu2+ и S2-
в) Al3+ и SO4 2-
г) Zn2+ и NO3-
А.5. При сливании каких двух растворов в воде практически не остается ионов? 5 -б
а) BaCl2 и Na2SO4
б) H2SO4 и Ba(OH)2
в) HNO3 + Ba(OH)2
г) HCl + Ba(OH)2
А.5. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды? 5 - г
а) нитрат калия и хлорид кальция
б) карбонат бария и соляная кислота
в) гидроксид бария и соляная кислота
г) гидроксид бария и серная кислота
А.5. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды? 5- в
а) сульфид натрия и соляная кислота
б) силикат натрия и соляная кислота
в) карбонат натрия и соляная кислота
г) хлорид натрия и серная кислота
А.6. Гидролиз соли можно усилить, если: 6 - б
а) охладить раствор
б) добавить воды
в) подкислить или подщелочить раствор
г) увеличить концентрацию соли
А.6. Какое органическое вещество подвергается гидролизу? 6 - а
а) сахароза
б) этиловый спирт
в) этиловый спирт
г) глицерин
А.6. Гидролиз какой соли идет по катиону? 6 - г
а) Na2S
б) LiNО3
в) BaBr2
г) ZnCl2
А.6. Гидролиз какой соли идет только по аниону? 6 - б
а) КС1
б) CH3COONa
в) A12(SО4)3
г) (NH4)2S
А.6. Укажите реакцию необратимого гидролиза: 6 - б
а) NH4C1 + Н2О → NH4OH + HC1
б) СаС2 + 2Н2О → Са(ОН)2 ↓ + С2Н2↑
в) С12Н22О11 + Н2О → C6H12O6 + C6H12O6;
глюкоза фруктоза
г) Na2S + Н20 → NaHS + NaOH
А.7. Найдите окислительно-восстановительную реакцию среди предложенных уравнений: 7 - г
а) H2SO4 + BaCl2 = BaSO4↓ + 2HCl
б) AgNO3 + HCl = AgCl↓ + HNO3
в) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
г) 2Al + 3CuCl2 = 2AlCl3 + 3Cu
А.7. Выберите схемы превращений, в которых происходит процесс окисления: 7 - а
а) S0 → S+4
б) S+6 → S-2
в) S0 → S-2
г) S+4 → S0
А.7. Сколько электронов сера должна принять или отдать, чтобы осуществить переход S+4 → S0: 7 - б
а) отдать 4e
б) принять 4e
в) принять 2e
г) отдать 6e
А.7. Окислитель... 7 - б
а) увеличивает свою степень окисления
б) принимает электроны
в) окисляется
г) отдает электроны
А.7. При взаимодействии с натрием сера проявляет... свойства. 7 - а
а) окислительные
б) основные
в) кислотные
г) восстановительные
А.8. При электролизе хлорида калия на катоде ( - электроде) выделяется 8 - в
а) К;
б) О2;
в) Н2;
г) Cl2.
А.8. При электролизе нитрата серебра на катоде ( - электроде) выделяется 8 - а
а) Аg;
б) О2;
в) Н2;
г) Cl2.
А.8. При электролизе хлорида калия на аноде (+ электроде) выделяется 8 - г
а) К;
б) О2;
в) Н2;
г) Cl2.
А.8. При электролизе нитрата серебра на аноде (+ электроде) выделяется 8 - б
а) Аg;
б) О2;
в) Н2;
г) Cl2.
А.8. Продуктами, выделяющимися на электродах при электролизе водного раствора CuBr2 8 - в
а) Сu и О2;
б) Н2 и Br2;
в) Сu и Br2;
г) Н2 и О2
А.9. Распределение электронов по энергетическим уровням в атоме магния 9 - а
а) s22s22p63s2
б) s22s22p63s1
в) 1s22s2
г) 1s22s22p5
А.9. Число электронов на внешнем энергетическом уровне у атомов щелочных металлов: 9 - а
а) 1
б) 2
в) 3
г) 4
А.9. Тип химической связи в простом веществе литий (Li): 9 - г
а) Ионная
б) Ковалентная полярная
в) Ковалентная неполярная
г) Металлическая
А.9. Простое вещество с наиболее ярко выраженными металлическими свойствами: 9 - г
а) Бериллий
б) Кальций
в) Магний
г) Стронций
А.10. Способ восстановления металлов более активным алюминием называется
10 - в
а) восстановление
б) алюминовосстановление
в) алюминотермия
г) электролиз.
А.10. Какой из перечисленных металлов встречается в природе в самородном состоянии: 10 - б
а) Алюминий
б) Медь
в) Хром;
г) Магний.
А.10. В виде какого минерала железо встречается в природе: 10 - в
а) Серый железняк
б) Желтый железняк
в) Красный железняк
г) Черный железняк.
А.10. Металлы из руд с помощью электролиза помогает получить: 10 - б
а) Металлотермия;
б) Электрометаллургия
в) Гидрометаллургия
г) Пирометаллургия
А.10. Какой восстановитель не используется в металлургическом производстве:
10 - а
а) Оксид углерода (IY);;
б) Оксид углерода (II);
в) Алюминий
г) Электрический ток.
А.11. Физические свойства белого фосфора: 11 - а
а) Температура плавления 44 оС
б) Не ядовит
в) Не светиться
г) Темно-красного цвета
А.11. Степень окисления фосфора равна: 11 - а
а) +5,+3,-3
б) -5,+5,+3
в) +5,-3,+2
г) +2,+3,-3
А.11. При высокой температуре хлорид аммония разлагается на: 11 - а
а) Аммиак и соляную кислоту
б) Ион аммония и хлор
в) Аммиак и хлор
г) Азот и соляную кислоту
А.11. Что является основным сырьем для производства керамических изделий? 11 - г
а) Медь
б) Фарфор
в) Стекло
г) Глина
А.11. Какие аллотропные видоизменения образует сера? 11 -а
a) Кристаллическая, пластическая сера
б) Пластическая сера
в) Чистая сера
г) Кристаллическая сера
А.12. Гидроксид кальция не взаимодействует с… 12 - а
а) СаО
б) HNО3
в) SiО2
г) CuSО4
А.12. Гидроксид натрия взаимодействует с … 12 - а
а) SО3
б) Na2О
в) Mg(OH)2
г) N2О
А.12. С раствором фосфорной кислоты реагирует 12 - а
а) CaO
б) N2
в) КС1
г) Р
А.12. В реакцию с соляной кислотой вступает 12 - г
а) ртуть
б) бромид бария
в) оксид серы (VI)
г) карбонат калия
А.12. Раствор соляной кислоты реагирует с каждым из двух веществ: 12 - а
а) AgNО3 и Mg(OH)2
б) Hg и SО2
в) ВаО и HI
г) Ba(NО3)2 и СО2
А.13. Укажите вещество Х в схеме превращений: Х + СО2 - СаСО3 13 - б
а) Са
б) СаО
в) Са(ОН)2
г) СаСl2
А.13. Раствор гидроксида натрия реагирует с раствором следующей соли: 13 - а
а) хлорид железа (III)
б) фосфат калия
в) нитрат бария
г) фосфат кальция
А.13. Соль не может быть получена при взаимодействии: 13 - б
а) основания с оксидом неметалла
б) оксида с водой
в) кислоты с солью
г) оксида со щелочью
А.13. Металлическое железо реагирует с раствором соли: 13 - а
а) хлорид олова (II)
б) хлорид магния
в) хлорид цинка
г) хлорид натрия
А.13. Раствор сульфата меди (II) не реагирует с: 13 - в
а) магнием
б) железом
в) ртутью
г) цинком
В.1. Неверным является утверждение, что получение аммиака из азота – это процесс: В.1 - а
а) разложения;
б) каталитический;
в) обратимый;
г) гомогенный.
В.1. Верно утверждение, что реакция нейтрализации – это реакция: В.1 - б
а) окислительно-восстановительная;
б) обмена;
в) всегда обратимая;
г) каталитическая.
В.1. Из перечисленных ниже процессов к химической реакции относится: В.1 - а
а) горение;
б) кипение
в) возгонка;
г) плавление
В.1. Необратимой является реакция: В.1 - в
а) разложения угольной кислоты;
б) получения сернистой кислоты из оксида серы(IV) и воды;
в) разложения гидроксида меди (П);
г) получения аммиака из простых веществ.
В.1. К реакциям ионного обмена относится реакция между: В.1 - а
а) раствором гидроксида калия и соляной кислотой;
б) магнием и серой;
в) цинком и соляной кислотой;
г) раствором хлорида меди (II) и железом.
В.2. Оцените справедливость суждений о скорости химических реакций. В.2 - б
А. При нагревании скорость одних реакций увеличивается, а скорость других - уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
а) верно только А
б) верно только Б
в) верны оба суждения
г) оба суждения неверны
В.2. Оцените правильность утверждений. В.2 - а
А. Катализатор - это вещество, которое увеличивает скорость химической реакции, но при этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
а) верно только А
б) верно только Б
в) верны оба суждения
г) оба суждения неверны
В.2. Оцените правильность утверждений. В.2 - б
А. При нагревании скорость многих реакций уменьшается.
Б. Катализатор - это вещество, которое увеличивает скорость химической реакции, но само в ней не расходуется
а) верно только А
б) верно только Б
в) верны оба суждения
г) оба суждения неверны
В.2. Оцените справедливость суждений. В.2 - а
А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
а) верно только А
б) верно только Б
в) верны оба суждения
г) оба суждения неверны
В.2. Оцените справедливость суждений. В.2 - в
А. При нагревании скорость реакций увеличивается.
Б. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия..
а) верно только А
б) верно только Б
в) верны оба суждения
г) оба суждения неверны
В.3. Взаимодействию сульфата меди (II) и гидроксида калия соответствует сокращенное ионное уравнение… В.3. Cu2+ + 2ОН-1 → Сu(ОН)2 ↓
В.3. При взаимодействии хлорида калия и нитрата серебра происходит
В.3. Реакция 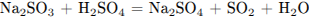 описывается сокращенным ионным уравнением В.3
описывается сокращенным ионным уравнением В.3 
В.3. Взаимодействию между веществами СН3СООН + NaOH соответствует краткое ионное уравнение В.3. Н+ + ОН- → Н2О
В.3. Какое сокращенное ионное уравнение соответствует взаимодействию хлороводородной кислоты и карбоната натрия? В.3 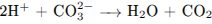
В.4. Соль, образованная слабым основанием и сильной кислотой гидролизуется по…( катиону; аниону; и по катиону и по аниону; не подвергается гидролизу). Нужное подчеркнуть. В.4. По катиону
В.4. Соль, образованная слабым основанием и слабой кислотой гидролизуется по…( катиону; аниону; и по катиону и по аниону; не подвергается гидролизу). Нужное подчеркнуть. В.4. и по катиону и по аниону
В.4. Соль, образованная сильным основанием и сильной кислотой гидролизуется по…( катиону; аниону; и по катиону и по аниону; не подвергается гидролизу). Нужное подчеркнуть. В.4. не подвернается гидролизу
В.4. Соль, образованная сильным основанием и слабой кислотой гидролизуется по…( катиону; аниону; и по катиону и по аниону; не подвергается гидролизу). Нужное подчеркнуть. В.4. По аниону
В.4. Гидролиз соли, образованной слабым основанием и слабой кислотой …(обратимый, необратимый, не происходит). Нужное подчеркнуть. В.4. Необратимый
В.5. Выберите схемы превращений, в которых происходит процесс окисления:
1. S0 → S+4 3. S0 → S-2
2. S+6 → S-2 4. S+4 → S0 В.5. 1
В.5. Выберите схемы превращений, в которых происходит процесс востановления:
1. S0 → S+4 3. S0 → S-2
2. S+6 → S-2 4. S+4 → S0 В.5. 2, 3, 4
В.5. Выберите схемы превращений, в которых происходит процесс восстановления:
1. N+2 → N+4 3. N+1 → N0
2. N+5 → N -3 4. N+3 → N+1 В.5. 2, 3, 4
В.5. Выберите схемы превращений, в которых происходит процесс окисления:
1. N+2 → N+4 3. N+1 → N0
2. N+5 → N -3 4. N+3 → N+1 В.5. 1
В.5. Азот является восстановителем в реакции:
1. Ca(OH)2 + NH4Cl = CaCl2 + NH3 + H2O 3. NH3 + HNO3 = NH4NO3
2. NO + H2 = N2 + H2O 4. NH3 + NO = N2 + H2O
В.5. 1
В.6. При электролизе водного раствора сульфата железа(II) на аноде протекает процесс…
2Н2О - 4ē→О2+4Н+;
4ОН-- 4ē→О2+2Н2О; *
Fe2+ +2ē→Fe0;
2Н2О+2ē→Н2+2ОН- . Нужное подчеркнуть.
В.6. При электролизе водного хлорида меди на катоде идет процесс
Cu0 – 2 ē→Cu2+;
2Н2О - 4ē→О20+4Н+;
Cu2++2ē→Cu; *
2Н2О+2ē→Н2+2ОН- . Нужное подчеркнуть.
В.6. При электролизе нитрата калия на аноде идет процесс
2Н2О - 4ē→О2+4Н+;
4ОН -- 4ē→ О2+ 2Н2О; *
K0 – ē → К+;
2Н2О + 2ē→ Н2+ 2ОН- . Нужное подчеркнуть.
В.6. При электролизе нитрата калия на катоде идет процесс
2Н+ + 2 ē → Н20; *
4ОН- - 4ē→ О2 + 2Н2О;
K0 - ē→К+;
2Н2О + 2ē→ Н2 + 2ОН- . Нужное подчеркнуть.
В.6. . При электролизе водного хлорида меди на аноде идет процесс
2Cl- – 2 ē→Cl0 ; *
2Н2О - 4ē→О20+4Н+;
Cu2++2ē→Cu;
2Н2О+2ē→Н2+2ОН- . Нужное подчеркнуть.
С.1. При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. С.1. С4Н9СООН
С.1. Предельный одноатомный спирт обработали хлороводородом. В результате реакции получили галогенопроизводное массой 39,94 г и 6,75 г воды. Определите молекулярную формулу исходного спирта. С.1. С5Н11ОН
С.1. В результате сплавления натриевой соли карбоновой кислоты с гидроксидом натрия массой 4,8 г получили карбонат натрия и газообразное органическое вещество массой 3,6 г. Определите молекулярную формулу полученного газообразного соединения.
С.1. С2Н6
С.1. При взаимодействии 6,72 л (н. у.) хлороводорода с равным объёмом газообразного амина получен продукт массой 24,45 г. Определите молекулярную формулу амина.
С.1. С2Н5NH2
С.1. В результате реакции предельного двухатомного спирта массой 30,4 г с избытком металлического натрия получено 8,96 л (н. у.) газа. Определите молекулярную формулу исходного спирта.
С.1. С3Н6(ОН)2


























