СОЛИ
Соли – ионные соединения, состоящие из катионов металлов (или иона аммония) и анионов кислотных остатков, например: ZnSO4, NH4NO3, KH2PO4.
1. Классификация солей
Соли подразделяются на следующие типы: средние, кислые, основные двойные и комплексные (таблица 1).
Таблица 1. Классификация солей Соли







Комплексные
K4[Fe(CN)6]
Двойные KNaCO3
Основные (CaOH)2SO4
Кислые KHCO3
Cредние Na2SiO3
Нормальными или средними солями называются продукты полного замещения ионов водорода кислоты ионами металлов, их также можно рассматривать как продукты полного замещения гидроксильных ионов основания ионами кислотных остатков.
Средние соли в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков, входящие в их состав:
Na2SO4 2Na+ + SO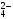 .
.
Кислые соли – продукты неполного замещения ионов водорода кислоты ионами металлов. Такие соли могут быть образованы только многоосновными кислотами.
При диссоциации кислых солей образуются катионы металла, водорода и анионы кислотного остатка. Все кислые соли диссоциируют ступенчато:
KHSO4 K+ + HSO ; (I)
; (I)
кислый
анион
HSO H+ + SO
H+ + SO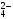 . (II)
. (II)
Суммарное уравнение диссоциации имеет вид:
KHSO4 K+ + H+ + SO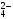 .
.
В основном диссоциация идет по первой ступени (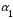
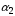 ). Образующийся при этом гидроанион многоосновной слабой кислоты является слабым электролитом и далее диссоциирует лишь в незначительной степени.
). Образующийся при этом гидроанион многоосновной слабой кислоты является слабым электролитом и далее диссоциирует лишь в незначительной степени.
Основные соли – продукты неполного замещения гидроксильных ионов основания ионами металлов. Такие соли образованы многокислотными основаниями, а также амфотерными гидроксидами.
При диссоциации основных солей образуются катионы металлов и анионы кислотных остатков и гидроксогрупп ОН . Все основные соли диссоциируют ступенчато:
. Все основные соли диссоциируют ступенчато:
AlOHCl2 AlOH2+ + 2Cl ; (I)
; (I)
основный
катион
AlOH2+ Al + OH
+ OH . (II)
. (II)
Суммарное уравнение диссоциации имеет вид:
AlOHCl2 Al + OH
+ OH + 2Cl
+ 2Cl .
.
Диссоциация основных солей идет преимущественно по первой ступени (
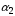 ), так как образующийся гидроксокатион многокислотного слабого основания является слабым электролитом и далее диссоциирует в незначительной степени.
), так как образующийся гидроксокатион многокислотного слабого основания является слабым электролитом и далее диссоциирует в незначительной степени.
Двойные соли – продукты полного замещения катионов водорода кислоты двумя разными ионами металлов.
При диссоциации двойных солей образуются катионы двух разных металлов и анионы кислотных остатков:
КAl(SO4)2 K+ + Al + 2SO
+ 2SO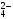 .
.
Комплексные соли – соли, полученные из простых молекул без образования общих электронных пар: [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II), K2[HgI4] – тетраиодомеркурат калия.
В состав комплексной соли входят комплексные катионы или анионы, например: [Cu(NH3)4] , [HgI4]
, [HgI4] , которые располагаются в узлах кристаллической решетки комплексного соединения, способные к самостоятельному существованию в растворе.
, которые располагаются в узлах кристаллической решетки комплексного соединения, способные к самостоятельному существованию в растворе.
Все комплексные соли диссоциируют ступенчато:
Na[Ag(CN)2] Na+ + [Ag(CN)2]  ; (I)
; (I)
комплексный
ион
[Ag(CN)2]  Ag+ + 2CN
Ag+ + 2CN . (II)
. (II)
2. Номенклатура солей
Названия средних (нормальных) солей по международной номенклатуре строят следующим образом: в первую очередь называют анион кислоты в именительном падеже, затем катион металла в родительном падеже. Если валентность (степень окисления) металла переменная, то ее указывают в скобках римской цифрой. Например, СоСl3 – хлорид кобальта (III); FeSO4 – сульфат железа (II); Cr2(SO4)3 – сульфат хрома (III); СaCl2 – хлорид кальция.
Названия кислых солей образуют добавлением слова гидро-, дигидро- и т.д. (в зависимости от числа атомов водорода, находящихся в кислом ионе), например:
NaHCO3 – гидрокарбонат натрия; Ca(H2PO4)2 – дигидрофосфат кальция, K2HBO3 – гидроборат калия.
Названия основных солей образуют добавлением слова
гидроксо-, дигидроксо- и т.д. (в зависимости от числа гидроксогрупп ОН , находящихся в основном ионе): (СuOH)2CO3 – гидроксокарбонат меди (II); [Al(OH)2]2SO4 – дигидроксосульфат алюминия, [Сr(OH)2]Cl – дигидроксохлорид хрома (III).
, находящихся в основном ионе): (СuOH)2CO3 – гидроксокарбонат меди (II); [Al(OH)2]2SO4 – дигидроксосульфат алюминия, [Сr(OH)2]Cl – дигидроксохлорид хрома (III).
Названия двойных солей образуют из названия аниона кислоты в именительном падеже и катионов металлов в родительном падеже, записанных через дефис: KCr(SO4)2 – сульфат калия-хрома (III); NH4Fe(SO4)2 – сульфат аммония-железа (III).
Названия комплексных солей начинают с аниона в именительном падеже, затем называют катион в родительном падеже.
Если в соединение входит комплексный катион, то сначала указывают число лигандов греческими числительными: 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта и т.д., затем наименование лигандов с добавлением соединительной -о, например, F – фторо-, Cl
– фторо-, Cl – хлоро-, Br
– хлоро-, Br – бромо-, I
– бромо-, I – иодо-,
– иодо-,
NO – нитрито-, NO
– нитрито-, NO – нитрато-, CN
– нитрато-, CN  – циано-, NH
– циано-, NH – амидо-, CNS
– амидо-, CNS – родано-,
– родано-,
OH – гидроксо-, Н
– гидроксо-, Н – гидридо-, SO
– гидридо-, SO – cульфито-, SO
– cульфито-, SO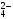 – сульфато-, S
– сульфато-, S O
O – тиосульфато-, СO
– тиосульфато-, СO – карбонато-, C
– карбонато-, C O
O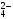 – оксалато-, PO
– оксалато-, PO – фосфато- и т.д. Далее называют нейтральные лиганды, в первую очередь, аммиак и его производные: NH3 – аммин, NO – нитрозо, Н2О – аква, и русское название комплексообразователя в родительном падеже с указанием его валентности. Например:
– фосфато- и т.д. Далее называют нейтральные лиганды, в первую очередь, аммиак и его производные: NH3 – аммин, NO – нитрозо, Н2О – аква, и русское название комплексообразователя в родительном падеже с указанием его валентности. Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II);
[PtCl(NH3)3(Н2О)2]Cl3 – хлорид монохлоротриамминдиакваплатины (IV).
Если в соединение входит комплексный анион, то также сначала называют число лигандов греческим числительным, далее – наименование лигандов, затем следует латинское название комплексообразователя с добавлением к его корню окончания -ат и указанием валентности комплексообразователя. В конце называют катион комплексной соли в родительном падеже. Например:
K4[Fe(CN)6] – гексацианоферрат (III) калия.
Na3[Co(NO2)6] – гексанитритокобальтат (III) натрия.
Химические свойства солей
1) Соли взаимодействуют с растворимыми основаниями:
А) Средние соли взаимодействуют с растворимыми основаниями с образованием новой соли и основания:
ZnCl2 + 2KOH → Zn(OH)2↓ + 2KCl;
Б) Кислые соли взаимодействуют с растворимыми основаниями с образованием средних солей и воды:
Ca(HCO3)2 + 2NaOH → СaCO3↓ + Na2CO3 + 2H2O;
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2 H2O;
В) Основные соли при взаимодействии со щелочами образуют основание и среднюю соль:
CuOHCl + KOH → Cu(OH)2↓ + KCl.
2) Соли взаимодействуют с кислотами:
А) Средние соли при взаимодействии с кислотами образуют новую среднюю соль и новую кислоту:
2KNO3 + H2SO4 → K2SO4 + 2HNO3;
Б) Кислые соли взаимодействуют с кислотами с образованием следующих продуктов реакции:
Na2HPO4 + H3PO4 → 2NaH2PO4;
KHSO4 + HCl → KCl + H2SO4;
В) Основные соли при взаимодействии с кислотами образуют среднюю соль и воду:
(CaОН)2SO4 + Н2SO4 → 2CaSO4↓ + 2H2O;
2Fe(OH)2Cl + 3Н2SO4 → Fe2(SO4)3 + 2HCl + 4H2O.
3) Соли взаимодействуют с металлами. При этом металл, стоящий левее в электрохимическом ряду напряжений, вытесняет последующие из растворов их солей:
Zn + CuSO4 = ZnSO4 + Cu↓.
4) Некоторые соли кислородосодержащих кислот подвергают разложению при нагревании:
CaCO3  CaO + CO2↑;
CaO + CO2↑;
(CuOH)2CO3  2CuO + CO2↑ + H2O.
2CuO + CO2↑ + H2O.
5) Соли могут взаимодействовать друг с другом с образованием новых солей. Поскольку эти реакции осуществляются в основном в водных растворах, они протекают лишь тогда, когда в продуктах реакции образуется малорастворимое вещество:
AgNO3 + NaCl → AgCl↓ + NaNO3.
Взаимодействие между кислой и основной солями идет с образованием средних солей и воды:
KHCO3 + CuOHCl → CuCO3↓ + KCl + H2O.
4. Способы получения солей
1) Получение средних (нормальных) солей
А) Взаимодействием металлов с неметаллами:
2Al + 3Cl2 → 2AlCl3.
Б) Взаимодействием кислот с основаниями:
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O.
В) Взаимодействием основных оксидов с кислотами:
CuO + H2SO4 → CuSO4 + H2O.
Г) Взаимодействием кислотных оксидов со щелочами:
CO2 + 2NaOH → Na2CO3 + H2O.
Д) Взаимодействием кислотных оксидов с основными:
СаО + SiO2 → CaSiO3↓.
Е) Взаимодействием кислот с металлами:
Zn + H2SO4 → ZnSO4 + H2↑.
Ж) Взаимодействием солей с кислотами:
2NaCl + H2SO4 → Na2SO4 + 2HCl.
З) Взаимодействием солей с металлами:
CuSO4 + Fe → FeSO4 + Cu↓.
И) Взаимодействием солей со щелочами:
CuSO4 + 2КОН → K2SO4 + Cu(OH)2↓.
К) Взаимодействием между двумя солями:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓.
2) Получение кислых солей
Кислые соли получают при неполном замещении атомов водорода в кислоте на катионы металла.
А) NaOH + H2CO3 → NaHCO3 + H2O;
избыток
Б) MgCO3 + H2CO3 → Mg(HCO3)2;
избыток
В) Na2CO3 + HCl → NaHCO3 + NaCl.
недостаток
3) Получение основных солей
Основные соли можно получить при неполном замещении гидроксильных групп основания кислотными остатками:
А) 2Al(OH)3 + H2SO4 → [Al(OH)2]2SO4 + 2H2O;
избыток недостаток
[Al(OH)2]2SO4 + H2SO4 → 2AlOHSO4 + 2H2O.
Б) Mg(OH)2 + MgSO4 → (MgOH)2SO4;
недостаток избыток
2NaOH + 2MgSO4 → (MgOH)2SO4 + Na2SO4.
недостаток избыток
5. Взаимные переходы солей различных типов
Для различных типов солей характерны взаимные переходы. Взаимосвязь различных типов солей наглядно можно проиллюстрировать схемой:


Основание
Основная соль
Средняя соль
Кислота
Кислая соль



 + +
+ +

 + основание + кислота
+ основание + кислота
Рассмотрим химические переходы на примере солей:
Добавив к нормальной соли одноименную кислоту, можно получить кислую соль:
MgCO3↓ + H2CO3 → Mg(HCO3)2.
Для обратного перехода кислой соли в нормальную необходимо к кислой соли прибавить щелочь:
Mg(НCO3)2 + 2NaOH → MgCO3↓ + Na2CO3 + 2H2O.
Для получения основной соли из нормальной необходимо добавить щелочь:
2MgCO3 + Вa(OH)2 → (MgОН)2CO3 + ВaCO3.
Для получения нормальной соли из основной необходимо добавить кислоту:
(MgОН)2CO3 + Н2CO3 → 2MgCO3↓ + 2H2O.
6. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
Какие из перечисленных соединений относятся к солям: H2SiO3, Ca(HCO3)2, KI, Al2O3, Ba(OH)2, KHCO3, (NH4)2SO4, [Al(OH)2]2SO4, ZnO, FeOHCl?
Укажите, какие из перечисленных солей являются средними, кислыми, основными: Сo(HSO4)2, As2S3, (NH4)2Cr2O7, NaHS, BiOHCO3, (AlOH)3(PO4)2.
Назовите следующие соединения: KClO3, K2Cr2O7, Na2SiO3, Na2S2O3, NaHCO3, [Al(OH)2]3PO4, AlOH(NO3)2, NH4HS, K2C2O4.
Составьте графические формулы следующих солей: сульфата алюминия, ортофосфата железа (II), гидроксосульфита цинка, гидрокарбоната бария, дигидрофосфата кальция.
Составьте схемы ступенчатой диссоциации следующих солей: Mg(HCO3)2, [Cr(OH)2]2SO4, Al(HS)3, Ca(H2PO4)2, K2[HgI4].
Составьте химические формулы следующих солей: сульфита кальция, тиосульфата натрия, нитрита бария, гидрокарбоната бария, гидроксосульфата цинка, ортофосфата алюминия, сульфида железа (III), хлората меди (II), бромида алюминия, дигидроксонитрата хрома (III), дигидрофосфата калия, сульфата калия-алюминия.
Какие из перечисленных металлов могут вытеснять свинец из раствора его соли: Cu, Zn, Mg, Na, Hg, Fe?
Какие из перечисленных соединений реагируют с содой (Na2CO3) в растворе: K2CO3, HCl, CaCl2, H2CO3, H2SO4, CuO, Na2SiO3, Ca(OH)2?
Приведите уравнения реакций получения следующих солей: хлорида железа (II), сульфида свинца, нитрата цинка, дигидроксосульфата алюминия, гидрофосфата натрия.
Можно ли получить указанные соли путем взаимодействия соответствующих основных оксидов и кислот: ZnCl2, CuS, Na2SO4, K2CO3? Приведите уравнения возможных реакций.
Какие из предложенных процессов возможны и осуществляются до конца? Ответ подтвердите молекулярными и ионными уравнениями реакций:
Al(OH)3 + NaCl → ;
CuSO4 + Ba(OH)2 → ;
PbS + KOH → ;
Fe(OH)3 + ZnCl2 → ;
BaCO3 + HNO3 → ;
K2SiO3 + HCl → .
Даны следующие вещества: медь, соляная кислота, хлор и кислород. Как, используя эти вещества, можно получить хлорид меди (II)? Составьте молекулярные и ионные уравнения реакций.
Осуществите цепь последующих превращений:
Mg → Mg(OH)2 → MgSO4 → (MgOH)2SO4 → MgCO3 →
→ Mg(HCO3)2 → MgCl2.
Допишите уравнения реакций получения солей:
Аl + I2 → ;
Fe + Cl2 → ;
Zn + S → ;
NaOH + H2CO3 (избыток) → ;
HCl + NH4OH → ;
2Mg(OH)2 (недостаток) + MgSO4 (избыток) → .
Допишите уравнения соответствующих реакций:
BaCO3 + H2CO3 → ;
Ca(H2PO4)2 + NaOH → ;
(PbOH)NO3 + HNO3 → ;
KHCO3 + CuOHCl → ;
(CuOH)2CO3  ;
;
CuOHCl + KOH → .
Составьте ионные уравнения.










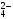 .
.  ; (I)
; (I)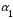
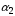 ). Образующийся при этом гидроанион многоосновной слабой кислоты является слабым электролитом и далее диссоциирует лишь в незначительной степени.
). Образующийся при этом гидроанион многоосновной слабой кислоты является слабым электролитом и далее диссоциирует лишь в незначительной степени. . Все основные соли диссоциируют ступенчато:
. Все основные соли диссоциируют ступенчато: ; (I)
; (I)  + OH
+ OH + OH
+ OH

















