8 класс Тема урока: «Оксиды. Состав, номенклатура, классификация. Физические свойства».
Цели урока:
образовательные: формирование у обучающихся представления о классе оксидов, их названии и классификации;
воспитательные:
– воспитывать отношение к химии как к одному из фундаментальных компонентов естествознания;
развивающие:
– развивать коммуникативные умения через работу в парах, развивать самостоятельность;
– формировать умения выделять главное, логически излагать материал;
– развивать мыслительную и познавательную деятельность учащихся.
Методы обучения:
беседа, объяснение, постановка и решение учебных проблем через реализацию системно-деятельностного подхода
Ресурсы:
Учебник Г.Е.Рудзитис, Ф.Г. Фельдман Химия 8 класс,, раздаточный материал, мультимедиа средства.
Тип:
урок изучения нового материала.
Ход урока
I. Организационный момент
Приветствие, проверка готовности к уроку, вступительное слово учителя.
II. Актуализация опорных знаний и способов действий обучающихся.
Провожу «мозговой штурм» для самостоятельного определения темы урока.
Тема сегодняшнего урока .... А вот это вы узнаете, когда отгадаете кроссворд. На работу вам отводится 2 мин. Работая парами, впишите химические термины в бланк и найдите ключевое слово.

По горизонтали:
1. Название элемента, имеющего относительную атомную массу 35,5
2. Название этого элемента содержит в своем составе хвойное дерево, а атом этого элемента весит 58 а.е.м.
3. Он бесцветный, но тяжелый,
В нем огонь всегда веселый.
Он в крови у нас живет,
Ну, конечно …
4. Назовите науку о веществах и их превращениях
5. Он с погодной стужей дружит,
Иногда лекарством людям служит,
Знает млад и стар народ –
Коль ушиб, то срочно нужен …
6. Назовите элемент, в названии которого спрятались названия сразу двух животных и находится он между 32 и 34 химическим элементом.
Правильно - оксиды. Это тема сегодняшнего урока. Запишите, пожалуйста, ее в тетради (слайд №1).
III. Изучение нового материала
С кислородом ходит парой,
То металл, то неметалл он,
Дружбу связями скрепит
Всем известный класс… (ОКСИД). (слайд№2)
Вспомните, пожалуйста, определение класса ОКСИДОВ и запишите его в тетрадь (слайд №3)
А знаете ли вы, что в 1870 году в Петербургской Академии обсуждалась возможность называть вещества следующим образом.
На экране формулы (H2O; KI; HCI; HNO3) (слайд № 4)
Например:
водород кислородович;
калий йодович;
водород хлорович;
водород азотович трехкислов
Назовите приведённые ниже формулы оксидов (слайд №4) по международной номенклатуре:
CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe 2O3
Какие трудности или вопросы возникли у вас при определении названий для каждого оксида? (Для некоторых пар оксидов соответствуют одинаковые названия: CO2 и CO).
Запомните: в подобных случаях вы действительно встречаетесь с оксидом одного и того же химического элемента, но в разных его валентных состояниях. Для "разведения" названий для каждого из веществ необходимо в конце указать валентность этого химического элемента. Названия оксидов, в составе которых имеются химические элементы с постоянной валентностью, даются без упоминания о валентности.
CO - оксид углерода (II)
CO2 - оксид углерода (IV)
Задание Назовите другие пары оксидов, образованные элементами с переменной валентностью- Fe и S. (FeO - оксид железа (II), Fe2O3 - оксид железа (III), SO2 - оксид серы (IV), SO3 - оксид серы (VI)).
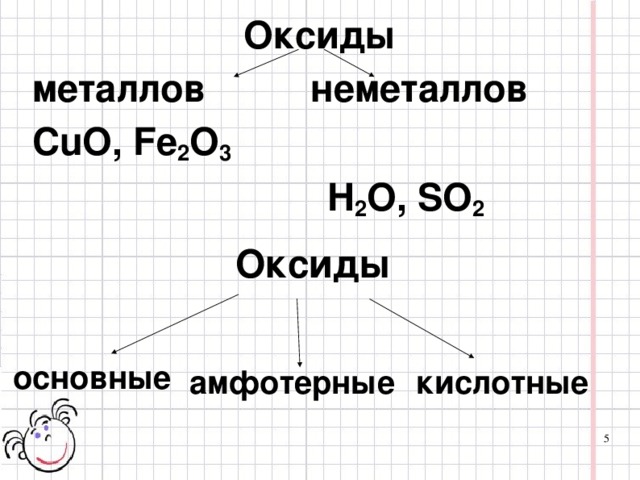
Давайте познакомимся с современной классификацией оксидов.
(слайд №5,6,7,8)
Обратите внимание и запомните: неметаллы образуют только кислотные оксиды.
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента. Например, CrO (II - основный); Cr2O3 (III - амфотерный); CrO3 (VI - кислотный)
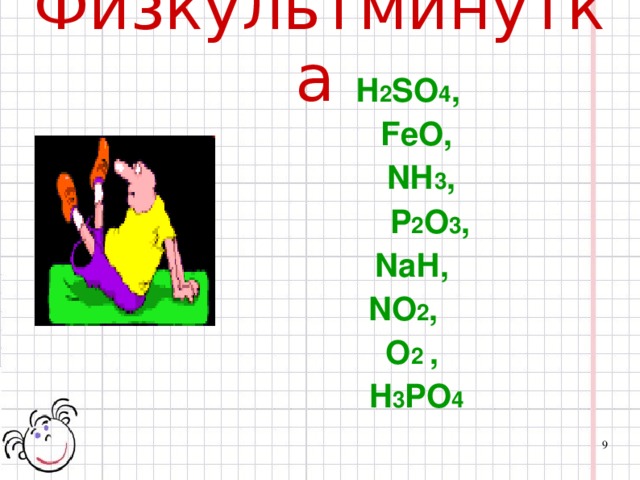
А теперь – физкультминутка. Но она у нас сегодня необычная и напрямую связана с темой нашего урока. На слайде вам будет показана формула вещества. Если оно является оксидом - вам нужно встать (слайд № 9)
Н2SO4, FeО, NН3, P2О3, NaН, NO2, О2 , Н3PО4
Задание Распределите приведённые формулы оксидов по группам – основные, кислотные, амфотерные: K2O, Al2O3, Сl2O7, FeO, MgO, P2O5, ZnO, CO2,
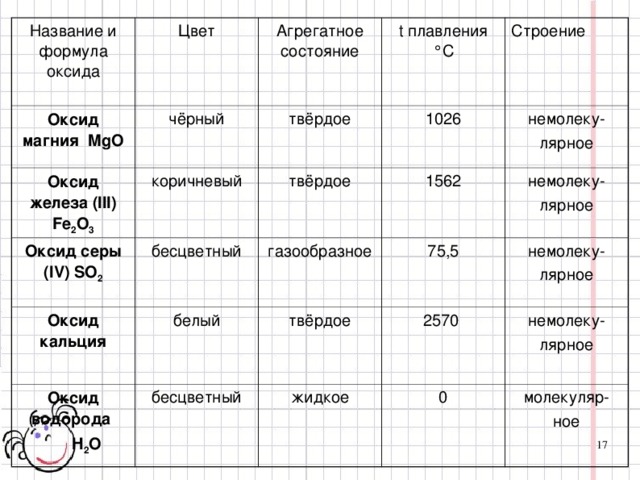
Физические свойства оксидов. Все физические свойства оксидов зашифрованы в данном стихотворении.
Широка натура у оксидов,
Камнем вниз, а то рекой течет,
А захочет - газ различных видов,
И веществ создаст круговорот.
Задание №3
Пользуясь материалом учебника, попытайтесь определить эти свойства (оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче окружающего воздуха). На места пропусков в задании вставьте соответствующие формулы оксидов (слайд №18 )
Сверьте свои ответы с правильными ответами на экране (слайд № 19)
IV. Закрепление материала
Задание№1 Химические «крестики-нолики»
| CO | MgO | P2O5 |
| Na2O | CO2 | CaO |
| K2O | Al2O3 | Fe2O3 |
Укажите оксиды неметаллов: Укажите оксиды металлов:
| CO | MgO | P2O5 |
| Na2O | CO2 | CaO |
| K2O | Al2O3 | SO3 |
Задание№2 «В земной коре – литосфере – находятся оксид алюминия (входит в состав глины), оксид кремния (IV) (песок), оксид железа (III)(содержится в красном железняке). Водная оболочка Земли – гидросфера – это оксид водорода. В воздухе есть оксид углерода (IV) (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющую атмосферу: оксид углерода (II) (угарный газ), оксид серы (IV) (сернистый газ), оксид азота (II) и оксид азота (IV)» Запишите формулы указанных оксидов, распределите по группам – кислотные и основные оксиды.
Задание№3 «Химическое домино»
Выданы карточки, на которых записано : Mg, O2, SO4, H2, O3, Fe2, O, Ca, C O, Al2, O3, CO3, Si Составьте формулы оксидов и назовите вещества.
V. Рефлексия
Урок подошёл к концу. Обратите внимание, что на экране записаны следующие фразы:
(слайд№20)
Меня удивило….
Я задумался…
У меня возник вопрос… Пожалуйста, закончите эти фразы в ваших тетрадях.
VI. Домашнее задание (слайд №21) Выучить правило номенклатуры оксидов и составление их формул, прочесть §40 c131 - 132, написать небольшое сообщение на тему «Оксиды в повседневной жизни человека»