Завязка урока начинается с электронного письма от ученицы седьмого класса, которая просит помочь ей составить опорный конспект по теме: Оксиды, состав, классификация, номенклатура, и физические свойства оксидов. В процессе урока учатся сворачивать информацию в опорный кластер.
Цель урока: познакомиться с бинарными соединениями их физическими свойствами, составом, классификацией, номенклатурой; повторить умения по формуле находить степени окисления в оксидах.
Просмотр содержимого документа
«Урок по химии в 8 классе. Бинарные соединения - оксиды.»

На электронную почту нашей школы пришло письмо ученицы 7 класса: Дорогие восьмиклассники помогите мне составить опорный конспект на тему:
Оксиды, состав, номенклатура, классификация.

Инструкция. Как составить опорный КОНСПЕКТ
Опорный конспект – это сокращенная символическая запись изучаемого материала, в которой сжато изображены основные смысловые вехи изучаемой темы.
Составить такую «шпаргалку» - значит проработать весь необходимый материал, структурировать свои знания, «разложить все по полочкам».
Главное условие: краткость, наглядность, минимум текстовой информации. Новые термины целесообразно записывать полностью.

- Причиной эффекта собачьей пещеры в Италии является оксид углерода СО2. Он тяжелее воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек может легко пройти по ней.

- Кислотные дожди появляются, когда с атмосферным кислородом и водяным паром соединяются оксиды серы и азота. Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.

- Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо.
- Песок, состоящий преимущественно состоит из SiO2, используют при производстве стекла.
- Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.

Что общего из приведенных оксидов?

Расставьте степень окисления в оксидах:
- MgO, CaO, CuO, Cu 2 O, Na 2 O, k 2 O, CO, SO 2 , NO,
- P 2 O 5 , Al 2 O 3 BeO, MnO 2 , SiO 2 , Fe 2 O 3 , FeO, ZuO

Перезагрузка.

Продолжаем составлять конспект.

Напишите формулы оксидов и наоборот дайте название.
- Оксид серы (IV), оксид фосфора(V), оксид углерода(IV), оксид серы(VI)
- MgO, CaO, CuO, Cu2O, Na2O, k2O, CO, SO2, NO, P2O5, Al2O3, BeO, MnO2, SiO2, Fe2O3, FeO, ZuO

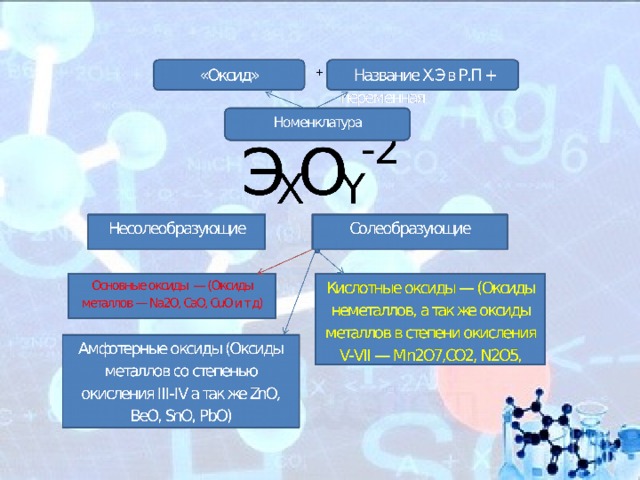
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO,CuO)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)

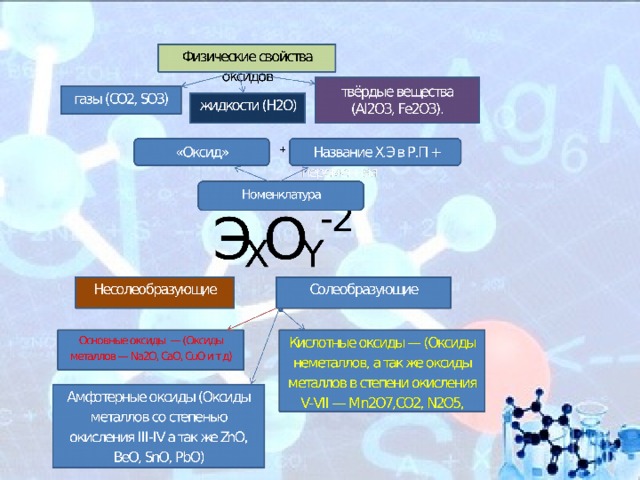
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Рефлексия. Итоги.

Ссылки использованных ресурсов.
- http://www.himikatus.ru/art/dif_news/vih.jpg
- https://avatars.mds.yandex.net/get-zen_doc/27036/pub_5b0e7ba248c85e2421e04039_5b0e7d1c40888a00a9101249/scale_1200
- https://sc01.alicdn.com/kf/HTB1onTKXnHuK1RkSndVq6xVwpXaz/Color-pigment-iron-oxide-fe2o3-for-concrete.jpg
- https:// ds02.infourok.ru/uploads/ex/0153/0005f4c2-335af2bc/img26.jpg









































