
Тема урока: «Серная кислота
и её свойства»

Цель урока:
Изучить свойства разбавленной серной кислоты. Сравнить свойства разбавленной и концентрированной серной кислоты
Маршрут путешествия
СТАНЦИЯ ЭКОЛОГИЧЕСКАЯ
СТАНЦИЯ СПАСИБО ЗА ВНИМАНИЕ!!!
СТАНЦИЯ ЭКСПЕРИМЕНТАЛЬНАЯ
СТАНЦИЯ МЕНДЕЛЕЕВСКАЯ
СТАНЦИЯ ИНФОРМАЦИОННАЯ
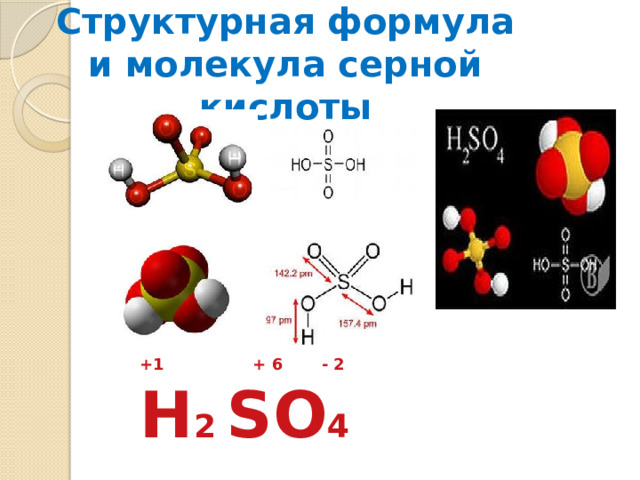
Структурная формула и молекула серной кислоты
+1 + 6 - 2
H 2 SO 4
Характеристика
Серная кислота – двухосновная,
кислородсодержащая, растворимая,
нелетучая,
сильная,
стабильная.

Физические свойства
серной кислоты
- Бесцветная маслянистая жидкость
- Обладает сильным гигроскопическим свойством

Правило разбавления кислот
Н 2 О
Сначала вода, потом кислота –
иначе случится большая беда !

«Опыт - это единственный верный путь спрашивать природу и слышать ответ в ее лаборатории». (Д.И.Менделеев)

Лабораторные опыты: Химические свойства разбавленной серной кислоты
1. Ознакомьтесь с инструкцией по выполнению лабораторных опытов (на парте)
2.При выполнении опытов соблюдайте правила техники безопасности.
Запишите уравнение химической реакции.
4. Сделайте вывод о результатах эксперимента.
5. Приведите рабочее место в порядок

Химические свойства разбавленной серной кислоты Взаимодействие с металлами ( до Н )
Mg + H 2 SO 4 → MgSO 4 + H 2 ↑
Cu + H 2 SO 4 →

Взаимодействие с оксидами металлов
CuO + H 2 SO 4 → CuSO 4 + H 2 O

Взаимодействие с основаниями
2NaOH + H 2 SO 4 → Na 2 SO 4 +2 H 2 O
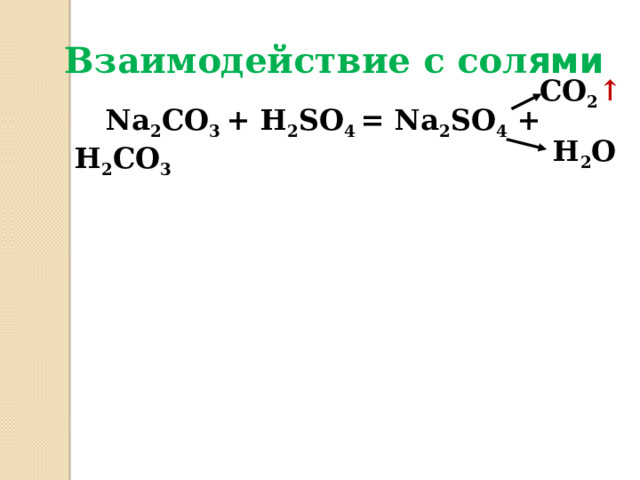
Взаимодействие с сол ями
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 CO 3
CO 2 ↑
H 2 O

Качественная реакция серную кислоту и ее соли
H 2 SO 4 +BaCI 2 → BaSO 4 ↓ + 2HCI
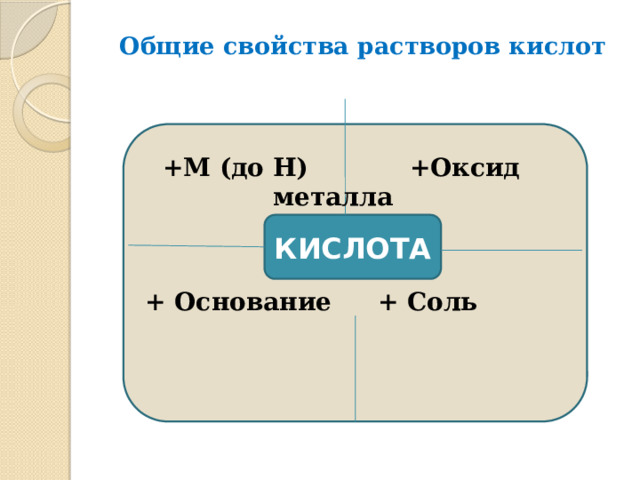
Общие свойства растворов кислот
+М (до Н) +Оксид металла
+ Основание + Соль
КИСЛОТА

Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb , H 2 , Cu,Hg, Ag, Au Концентрированная серная кислота взаимодействует со всеми металлами, кроме золота и платины. (Концентрированная серная кислота на холоде пассивирует Al, Cr, Fe.) Водород при этом не выделяется, а образуются соединения серы с более низкими степенями окисления SO 2 , S или H 2 S - в зависимости от активности металла или условий реакции.

Разрушающее действие
концентрированной серной кислоты
(обугливание древесины)
Серная кислота - сильное водоотнимающее средство: она отнимает молекулы воды от органических соединений.

Обугливание сахарозы серной кислотой
C 12 H 22 O 11 + 2H 2 SO 4 →11C + 13H 2 O + CO 2 + 2SO 2 +Q

Окислительные свойства конц. H 2 SO 4
H 2 S
H 2 SO 4(конц.) + M → M 2 (SO 4 ) n + S + H 2 O
SO 2
Hg 0 + H 2 S +6 O 4 → S +4 O 2 + Hg +2 SO 4 + H 2 О
Hg 0 - 2е → Hg +2
2
1 восстановитель
S +6 + 2 е → S +4
2
1 окислитель
Hg 0 + 2 H 2 S +6 O 4 → S +4 O 2 + Hg +2 SO 4 + 2 H 2 О
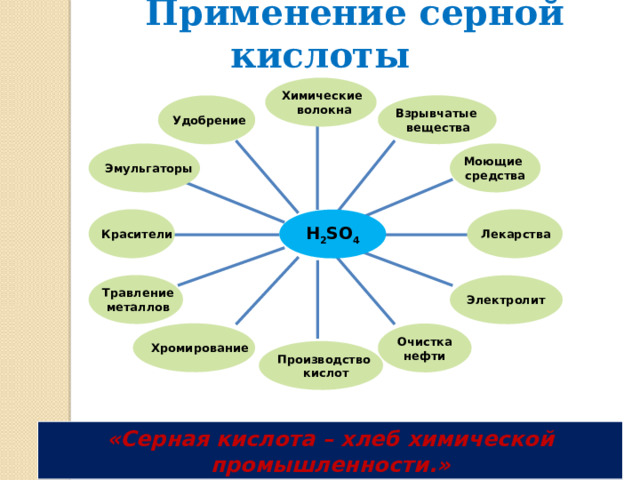
Применение серной кислоты
Химические
волокна
Взрывчатые
вещества
Удобрение
Эмульгаторы
Моющие
средства
Красители
Лекарства
H 2 SO 4
Травление
металлов
Электролит
Хромирование
Очистка
нефти
Производство
кислот
«Серная кислота – хлеб химической промышленности.»
20
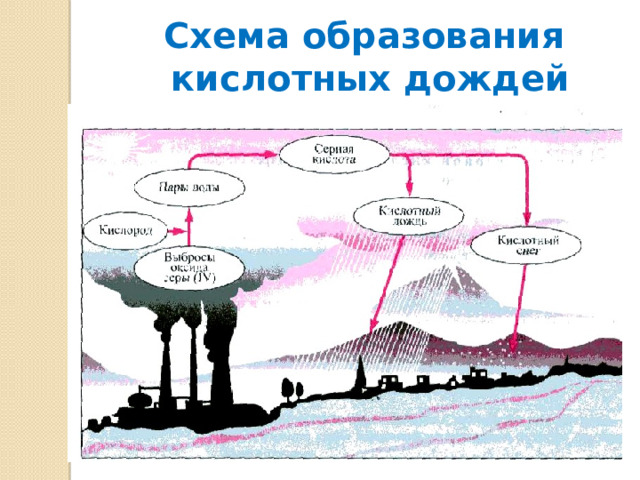
Схема образования кислотных дождей

Тест
1. Формулы продуктов взаимодействия концентрированной серной кислоты с серебром
1) H 2 и Ag 2 SO 4 2) SO 2 , H 2 O и Ag 2 SO 4
3) H 2 S , H 2 O и Ag 2 SO 4 4) реакция не идет
2. Ионное уравнение реакции MgO + 2H + = Mg 2+ + H 2 O соответствует взаимодействию
1) Mg+H 2 SO 4 2) MgO+H 2 SO 4
3) Mg(OH) 2 +H 2 SO 4 4) MgCO 3 +H 2 SO 4
3. Формула вещества, проявляющего только окислительные свойства 1) H 2 S 2) H 2 SO 3 3) H 2 SO 4 4) SO 2
4.Сумма коэффициентов в уравнении реакции AI + H 2 SO 4 = AI 2 (SO 4 ) 3 + H 2 равна 1) 10 2) 11 3) 9 4) 8
5.В концентрированной серной кислоте окислителем является 1) кислород 2) водород 3) сера 4) все три элемента
6.В разбавленной серной кислоте окислителем является
- Кислород 2) водород 3) сера 4) все три элемента
- Кислород 2) водород 3) сера 4) все три элемента
- Кислород 2) водород 3) сера 4) все три элемента
7. Разбавляя концентрированную серную кислоту, необходимо
1) Вливать воду в кислоту 2) вливать кислоту в воду 3) без разницы
20

Ключ для проверки теста
- 1) 2
- 2) 2 «5» - 7 заданий
- 3) 3 «4» – 6 заданий
- 4) 3 «3» - 4-5 заданий
- 5) 3
- 6) 2
- 7) 2
Домашнее задание
§ 27, упр.5 с.204 + карточка с задачами
(по желанию)
- Такие виды рыб, как форель и хариус, очень чувствительны к чистоте воды. Если в 1 л природной воды содержится 3∙10-6моль серной кислоты (которая может попадать в реки с промышленными стоками или за счет «кислотных дождей»), то мальки этих рыб погибают. Вычислите ту массу серной кислоты в 1 л воды, которая представляет собой смертельную дозу для мальков форели и хариуса. «Кислотные дожди» - следствие деятельности человека: при сжигании различного топлива (бензина, керосина, нефти, угля) в атмосферу выделяется огромное количество диоксида серы. Взаимодействуя с кислородом воздуха и атмосферной влагой этот оксид превращается в серную кислоту. Определите концентрацию серной кислоты, полученной из газовых выбросов химзавода, содержащих 20 кг диоксида серы. Объем воды, в которой будет растворена полученная серная кислота, примите равным 10 000м 3 .
- Такие виды рыб, как форель и хариус, очень чувствительны к чистоте воды. Если в 1 л природной воды содержится 3∙10-6моль серной кислоты (которая может попадать в реки с промышленными стоками или за счет «кислотных дождей»), то мальки этих рыб погибают. Вычислите ту массу серной кислоты в 1 л воды, которая представляет собой смертельную дозу для мальков форели и хариуса.
- «Кислотные дожди» - следствие деятельности человека: при сжигании различного топлива (бензина, керосина, нефти, угля) в атмосферу выделяется огромное количество диоксида серы. Взаимодействуя с кислородом воздуха и атмосферной влагой этот оксид превращается в серную кислоту. Определите концентрацию серной кислоты, полученной из газовых выбросов химзавода, содержащих 20 кг диоксида серы. Объем воды, в которой будет растворена полученная серная кислота, примите равным 10 000м 3 .















































