Открытый урок по теме «Серная кислота - кислородсодержащая кислота. Особые свойства концентрированной серной кислоты»
Дата: 27.02.2019г
Предмет: химия
Класс: 11
Учитель: Еферова Н.И.
Цель: изучение свойств концентрированной серной кислоты, действие ее на металлы, органические вещества, выявить отличительные свойства от разбавленной серной кислоты.
Задачи:
образовательная: расширить знания, учащихся о свойствах концентрированной серной кислоты, развить умения выделять существенные признаки, анализировать факты, делать выводы;
воспитательная: развивать познавательный интерес к химии, коммуникативные качества, умение работать в команде, воспитать у учащихся уверенность в себе, ввести прием оценивания как фактор реализации принципа психологической комфортности;
развивающая: формировать навыки самостоятельной работы с учебным материалом и инструкциями к лабораторным опытам.
Тип урока: Урок – исследование особых свойств концентрированной серной кислоты.
Межпредметные связи: экологические проблемы, связанные с производством и использованием серной кислоты.
Формы организации познавательной деятельности: фронтальная с элементами индивидуальной и групповой.
Методы: лабораторные опыты с элементами беседы, исследовательская работа, самостоятельная работа
Средства обучения: оборудование и реактивы для опытов, дидактический материал, мультимедийная презентация.
Эпиграф «Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опыта необходимо».
А. М .Бутлеров.
Ход урока
Организационно-мотивационный момент.
-Сегодняшний урок я бы хотела начать с эпиграфа «Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опыта необходимо». Да, действительно мы при помощи опытов будем доказывать факты.
И сегодня объектом нашего внимания будет необыкновенная особа (показать в колбе раствор серной кислоты), которая появилась в поглотительной башне. Её папа Оксид серы(YI) был мужчиной злого нрава и носил прозвище Серный ангидрид. Её мама была простой, спокойной женщиной, звали её Вода. Союз оксида и воды привёл к появлению нашей незнакомки, которую назвали (ответ учащихся).
Вот с этой кислотой, которую во времена Петра I привозили в Россию из-за границы. называли «купоросным маслом»,» мы и продолжим знакомство. Современное название этого вещества – серная кислота.
- Что вам известно о серной кислоте и что бы еще хотели узнать? (изучить свойства разбавленной и концентрированной кислот, и выяснить чем они отличаются).
Тема нашего урока «Серная кислота - кислородсодержащая кислота. Особые свойства концентрированной серной кислоты»
1. Постановка целей и задач.
-Итак, свойства разбавленной и концентрированной серной кислоты отличаются между собой. Почему? Это нам предстоит сегодня выяснить.
(Класс делится для исследования свойств концентрированной серной кислоты на 4 рабочие группы по 3-4 человека. Каждая группа получает инструкцию по проведению исследования в определенной области. Учитель выступает в роли координатора).
-Для изучения свойств серной кислоты нам понадобится лист ответов.
- Задания по группам позволяют выявить особые свойства серной кислоты. Эти сведения вы должны зафиксировать в карте расследования по определенным разделам. Заполненная карта расследования к концу урока будет рабочей страницей в вашей тетради по данной теме.
III.Инструктаж по технике безопасности и ходу работы.
-Так как мы работаем с кислотой, какие правила техники вы должны соблюдать? (При работе с серной кислотой следует соблюдать особую осторожность. Поэтому попавшую на кожу или одежду концентрированную серную кислоту следует немедленно смыть большим количеством воды).
-Сейчас в течение 10 минут вы самостоятельно в микрогруппах проведете реакции характерные для серной кислоты, и затем каждая группа отчитается по своему свойству перед всеми. И так приступаем.
Работа в группах. (Для достижения данных целей группы. Каждая группа получает задание – инструкцию по проведению расследования).
Инструкция для 1 группы
Лабораторный опыт: (соблюдайте правила ТБ)
Строение молекулы серной кислоты. Физические свойства. Отношение серной кислоты к индикаторам. Распознавание солей серной кислоты.
Прочитать текст, напишите молекулярную, структурную формулу серной кислоты. Назовите физические свойства кислоты и историческом названии кислоты.
В три пробирки налейте по 1-2 мл разбавленного раствора серной кислоты. В первую пробирку добавьте несколько капель фенолфталеина, во вторую – метиловый оранжевый, в третью – опустите лакмусовую бумажку. Результаты запишите в таблицу.
Каково отношение серной кислоты к индикаторам?
Лабораторный опыт «Качественная реакция на сульфат-ион».
В пробирку прилейте 1-2 мл серной кислоты (при работе с кислотами соблюдайте особую осторожность!).
К серной кислоте прилейте раствор хлорида бария. Какие признаки химической реакции вы наблюдаете?
Результаты запишите в таблицу.
Проработайте этот материал в группе и подготовьте выступление о своей работе.
1. Строение молекулы серной кислоты
Молекула серной кислоты содержит серу, степень окисления которой + 6, наивысшая, поэтому серная кислота проявляет окислительные свойства.
2. Физические свойства
Серная кислота - бесцветная маслянистая жидкость, почти в 2 раза тяжелее воды (p = 1.84 г/см3), при растворении в воде выделяется много теплоты, поэтому всегда нужно помнить о правиле разбавления серной кислоты: нужно лить кислоту в воду, а не наоборот!!!
Концентрированная кислота вызывает ожоги, разъедает ткани. В России в XVII веке серную кислоту называли "купоросным маслом" или "купоросным спиртом" На Руси серная кислота появилась в XVII в. Называли ее купоросным маслом, так как она образуется при прокаливании "купороса". Мировые потребности серной кислоты в средние века ограничивались десятками килограммов в год. Она производилась для нужд аптек и алхимических лабораторий. Некоторое количество концентрированной кислоты шло для производства особых спичек, содержащих бертолетову соль. В небольших количествах серная кислота с 1767 г. стала применяться на "Московском суконном дворе" при крашении тканей. Использовали её и для получения азотной и соляной кислот. Впервые разрешение на производство серной кислоты и "духа купоросного", т.е. серного ангидрида, было дано Петром I в 1718 г. гражданам Савелову и братьям Томилиным. В разрешении сказано: "... позволение делать купорос, краску мумию, масло и дух купоросный и крепкую водку и иные вещи, которые из купоросной руды произведены быть могут..." В конце XVIII в. отдельные заводы изготовляли в год по 1-2т. Развитие производства долгое время тормозилось вследствие указа, изданного Анной Иоанновной в 1733 г., в котором запрещалось производить, продавать и покупать различные ядовитые вещества, в том числе и "купоросное масло", т.е. серную кислоту. Но потребности в серной кислоте заставили ограничить действие этого указа, особенно в XIX в.. В то время в России было уже 17 "купоросно-масляных" заводов.
Инструкция для 2 группы
Лабораторный опыт: (соблюдайте правила ТБ)
Общие свойства серной кислоты с другими кислотами
В четыре пробирки налейте по 1-2 мл разбавленного раствора серной кислоты.
В первую пробирку положите 1 гранулу цинка, во вторую - немного оксида меди и осторожно нагрейте, в третью добавьте – гидроксида меди (получите его реакцией обмена между NaOH и CuSO4), в четвертую - добавьте K2CO3.
Запишите уравнения химических реакций:
взаимодействия с металлами;
взаимодействия с основными оксидами;
взаимодействия с основаниями;
реакции обмена с солями.
Результаты запишите в таблицу.
Проработайте этот материал в группе и подготовьте выступление о своей работе.
- Обращаем внимание, что окислителем в реакциях с металлами является ион водорода. Все остальные реакции проходят без изменения степени окисления элементов,
Инструкция для 3 группы.
Лабораторный опыт: (соблюдайте правила ТБ)
Окислительные свойства концентрированной кислоты серной кислоты.
В две пробирки налейте по 1-2 мл концентрированной серной кислоты. В первую пробирку добавьте гранулу цинка, во вторую –немного порошка меди.
Как концентрированная серная кислота относится к данным металлам?
Запишите уравнение реакции с медью, цинком (используя таблицу).
Расставьте коэффициенты методом электронного баланса. Результаты запишите в таблицу
Проработайте этот материал в группе и подготовьте выступление о своей работе.
В концентрированных растворах окислителем является ион SO4-2 (за счет S). Чем активнее металл, тем выше содержание продуктов, где сера имеет более низкие степени окисления (т. е. свободной серы и сероводорода). С Си и другими малоактивными металлами при нагревании образуется SO2.
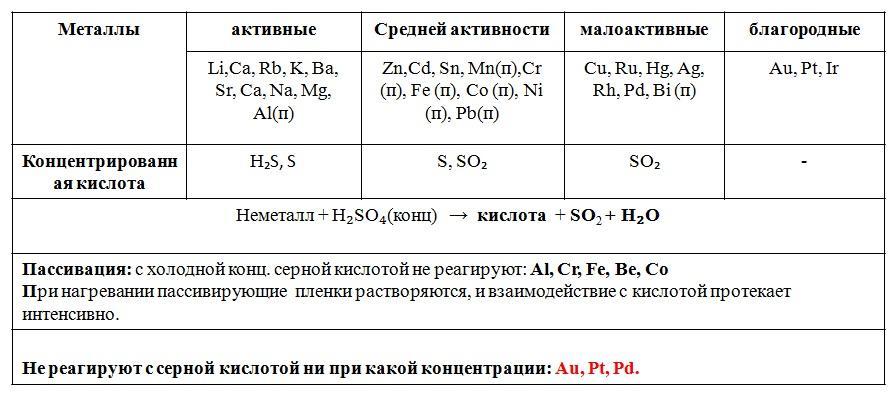
Горячая концентрированная серная кислота окисляет почти все металлы (исключение составляют золото, платина и некоторые похожие на них по химическим свойствам металлы, стоящие последними справа в ряду напряжения).
Концентрированная Н2SО4 при обычной температуре или на холоде не реагирует с Аl, Cо, Fе,Ni. Это позволяет перевозить кислоту выше 75% в стальных цистернах. Объясняется следующими причинами. Скорость растворения Fе с повышением % концентрации сильно увеличивается, а начиная с 72,09% падает, так как металла образуется тончайшая невидимая для глаза пленка сульфата железа, нерастворимая в Н2SО4. Имеется также предположение, что на поверхности металла образуется пассивный слой, состоящий из оксида железа FеО2.
Окислительно-восстановительные свойства концентрированной серной кислоты отличаются от свойств разбавленной кислоты. Концентрированная серная кислота является сильным окислителем, но в качестве окислителя выступают не ионы водорода, а сера, входящая в состав кислоты.
Инструкция для 4 группы
Лабораторный опыт: (соблюдайте правила ТБ)
Влияние среды на окислительно-восстановительные реакции
В три пробирки налью по 1-2 мл раствора перманганата калия KMnO4.
В первую пробирку прилью 1-2 мл разбавленной серной кислоты H2SO4, во вторую 1-2 мл воды, в третью - 1-2 мл концентрированного раствора щелочи (KOH).
В каждую пробирку добавлю по 2-3 мл свежеприготовленного раствора сульфита натрия Na2SO3. Отмечу наблюдения. (Учтите, что фиолетовая окраска характерна для ионов MnO4-, бесцветная или слабо-розовая для ионов Mn2+, зеленая - для ионов MnO42-, бурый цвет имеет осадок MnO2).
Отметьте как изменяется окраска раствора в пробирке?
пробирка 1- цвет
пробирка 2 – цвет
пробирка 2 – цвет
Как влияет кислая среда на характер протекания реакции между KMnO4 и сульфитом натрия? Запишите уравнение реакции. Расставьте коэффициенты методом электронного баланса. Сделайте вывод об изменениях степени окисления марганца в разных средах.
Результаты запишите в таблицу.
Проработайте этот материал в группе и подготовьте выступление о своей работе.
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Удаление пятен от ржавчины.
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+ - ионов), нейтральной (Н2О) и щелочной (избыток гидроксид – ионов ОН-). В зависимости от среды может измениться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. В результате окисления сульфита натрия перманганатом калия в кислой среде, создаваемой серной кислотой (KMnO4 + Na2SO3 + H2SO4 =?) происходит образование средних солей сульфатов марганца (II), натрия и калия, а также воды.
IV. Отчет каждой группы по выполненным заданиям с последующим заполнением рабочих листов. (На каждом этапе урока проводится рефлексия, подводится итог, делаются выводы, они фиксируются в рабочем листе).
V. Отношение концентрированной кислоты к органическим веществам. (Демонстрация опыта учителем).
1. Лабораторный опыты.
1) растворение кислоты в воде.
- Хорошо растворяется в Н2О, выделяя большое количество тепла. Поэтому нельзя приливать воду к концентрированной серной кислоте, следует, наоборот, серную кислоту приливать к возможно большему количеству воды. Сначала вода, потом кислота, иначе случится большая беда!
Особым свойством концентрированной серной кислоты является ее способность отнимать
воду, поэтому ее используют как гигроскопическое средство во многих химических реакциях,
особенно при получении органических веществ, для осушки или предотвращения поглощения
веществами воды.
2) воздействие кислоты на растения
- Концентрированная кислота очень гигроскопична: энергично поглощает влагу и отнимает воду от многих органических веществ. Кроме того, благодаря этой способности, концентрированная серная кислота обугливает органические вещества (сахар, древесину), вызывает сильные ожоги кожи.
3) Отношение к органическим веществам.
Описание опыта «Обугливание сахара». Оборудование: стакан, стеклянная палочка.
Реактивы: концентрированная серная кислота, сахарная пудра, вода.
Ход работы:
Смешать 20 г сахарной пудры, 3 мл воды, 10 мл серной кислоты, оставить стеклянную палочку в стакане. Наблюдается обугливание массы и увеличение ее в объеме.
Н2SO4 (концентрированная) обугливает органические вещества.
Опустим лучину в концентрированную Н2SO4. Результат – мы видим обугливание древесины. Такое же воздействие происходит на другие органические вещества: сахар, кожу, ткани.
4) Опыт «Дым без огня»
Реактивы: поваренная соль, концентрированная серная кислота, нашатырный спирт.
На дно стакана поместить поваренную соль, добавить концентрированную серную кислоту, после появления дыма хлороводорода внести, смоченную нашатырным спиртом, вату в стакан, появляется дымок – это хлорид аммония.
Очень часто применяют данный опыт фотографы, при съемках пейзажей, создавая эффект тумана.
VI. Закрепление в виде экспресс-опроса.
Какой по силе является серная кислота? Серная кислота является сильной кислотой.
Какие реакции 3-х типов характерны серной кислоте? В ступает в реакции трех типов: кислотно-основные, ионные, окислительно- восстановительные.
С какими веществами реагирует серная кислота? Реагирует с металлами, с основаниями и с основными оксидами.
Как можно обнаружить серную кислоту и ее соли? Для определения серной кислоты служат ионы бария. Выпадает белый осадок
Какой элемент является окислителем у разбавленной серной кислоты и у концентрированной серной кислоты? У концентрированной серной кислоты окислителем является элемент образующий кислотный остаток - SO42- , за счет атома серы в максимальной степени окисления. Окислительные свойства SO42- значительно выше, чем иона водорода Н+.
Каковы особые свойства концентрированной серной кислоты? Концентрированная серная кислота взаимодействует практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после водорода, кроме золото и платины, также с многими неметаллами. Концентрированная кислота очень гигроскопична: энергично поглощает влагу и отнимает воду от многих органических веществ. Кроме того, благодаря этой способности, концентрированная серная кислота обугливает органические вещества (сахар, древесину), вызывает сильные ожоги кожи.
На этапе обобщения и систематизации знаний, учащиеся проводят экспертизу полученных результатов и делают вывод: Серная кислота является сильной кислотой. В ступает в реакции трех типов: кислотно-основные, ионные, окислительно- восстановительные. Реагирует с металлами, с основаниями и с основными оксидами. Для определения серной кислоты служат ионы бария. Выпадает белый осадок. У концентрированной серной кислоты окислителем является элемент образующий кислотный остаток - SO42- , за счет атома серы в максимальной степени окисления. Окислительные свойства SO42- значительно выше, чем иона водорода Н+, поэтому концентрированная серная кислота взаимодействует практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после водорода, кроме золото и платины, также с многими неметаллами. Учащиеся записывают вывод в таблицу.
Почему склянку с концентрированной серной кислотой нельзя оставить открытой?
Почему не замерзнет стекло, если стакан с концентрированной серной кислотой поставить зимой между рамами?
Какую серную кислоту надо взять, чтобы растворить ртуть: концентрированную или разбавленную?
Какую первую помощь необходимо оказать при попадании кислоты на кожу рук?
Объясните образование «химического молока» при сливании сульфата натрия и хлорида бария?
VII. Домашнее задание
1. Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты:
1. AI + H2SO4 (конц.) →
2. Ag + HNO3 (конц.) →
3. KBr + KMnO4 + H2SO4 → … + Br2 + K2SO4 + H2O
2. Учебник: учить стр.128-135
3.Творческое здание: выполнить мини- газету «Серная кислота – «хлеб химии». (почему? доказательства)
4. (Профильный уровень) записать уравнения реакций между KMnO4 и сульфитом натрия в щелочной и нейтральной средах. Расставить коэффициенты методом электронного баланса
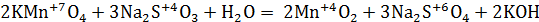
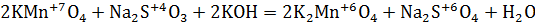
VIII.Рефлексия.
1. Усвоил полностью
2.В основном усвоил, но требуется ещё разобрать дома
3. Не понял тему
4. Очень было интересно выполнять опыты.

























