Просмотр содержимого документа
«Презентация к уроку химии в 10 классе на тему "Арены. Бензол"»

- Первые представители этого класса УВ, выделенные в XIX веке из природных объектов, обладали приятным ароматом, за что и получили своё название. В молекулах есть ароматическая связь (бензольное кольцо).
- Строение молекулы главного представителя этого класса приснилось немецкому учёному Ф. Кекуле в виде змеи, вцепившейся в собственный хвост.

Урок химии 10 класс Арены Бензол.
Цель. Сформировать у учащихся знаний об аренах, как соединениях, имеющих бензольное кольцо (ароматическую связь).

План работы на уроке:
- Изучить особенности строения аренов на примере молекулы бензола
- Рассмотреть изомерию, номенклатуру.
- Познакомиться способами получения.
- Изучить свойства, опираясь на строение
- Познакомиться с применением.
- Закрепить изученный материал.



История открытия
- Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.

Второе рождение
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который обнаружил в баллонах со светильным газом подвижную бесцветную жидкость со своеобразным запахом, которую назвал «карбюрированный водород».

Новое получение
- В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)

Юстус Либих
- Дал веществу название «бензол»
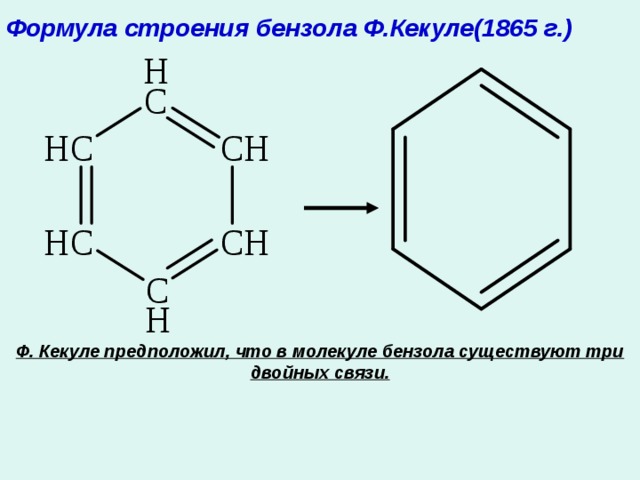
Формула строения бензола Ф.Кекуле(1865 г.)
Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
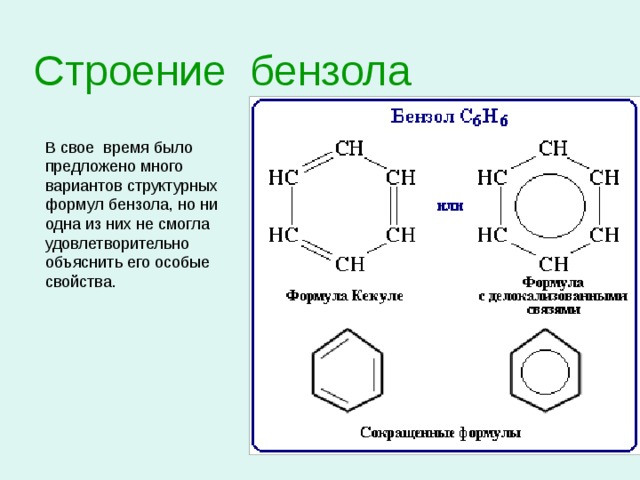
Строение бензола
В свое время было
предложено много
вариантов структурных
формул бензола, но ни
одна из них не смогла
удовлетворительно
объяснить его особые
свойства.

При проведении реакций, выяснилось, что бензол не обесцвечивает растворы марганцовки и бромной воды (хотя, судя по формуле, он является непредельным УВ). Оказывается, наиболее характерными для него являются реакции замещения, а в реакции присоединения он вступает только в жёстких условиях.
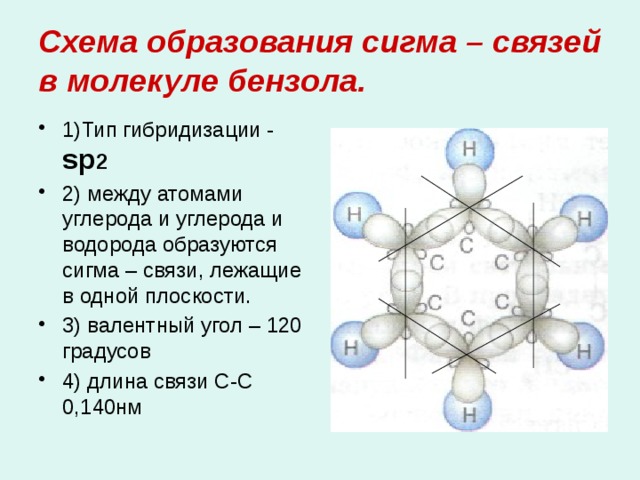
Схема образования сигма – связей в молекуле бензола.
- 1)Тип гибридизации - sр 2
- 2) между атомами углерода и углерода и водорода образуются сигма – связи, лежащие в одной плоскости.
- 3) валентный угол – 120 градусов
- 4) длина связи С-С 0,140нм

Схема образования пи – связей в молекуле бензола
- р – электронных облаков в молекуле бензола перпендикулярно плоскости образования сигма - связей образуется единая
п- электронная система, состоящая из 6 р – электронов и общая для всех атомов углерода.
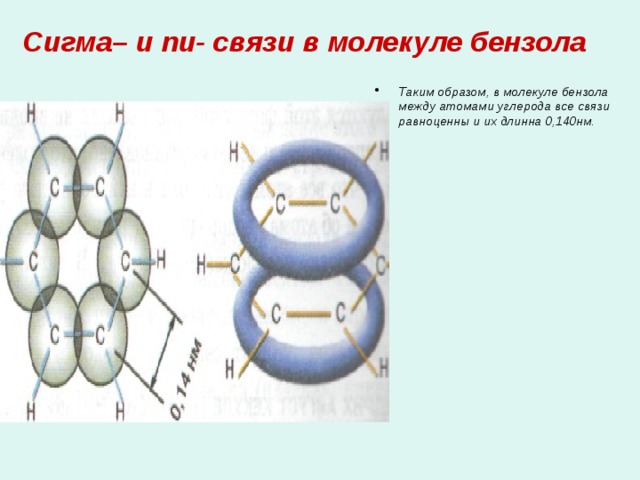
Сигма– и пи- связи в молекуле бензола
- Таким образом, в молекуле бензола между атомами углерода все связи равноценны и их длинна 0,140нм.
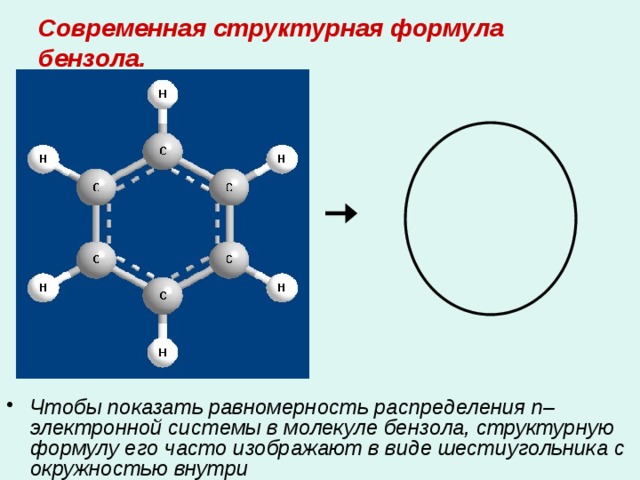
Современная структурная формула бензола.
- Чтобы показать равномерность распределения п–электронной системы в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри
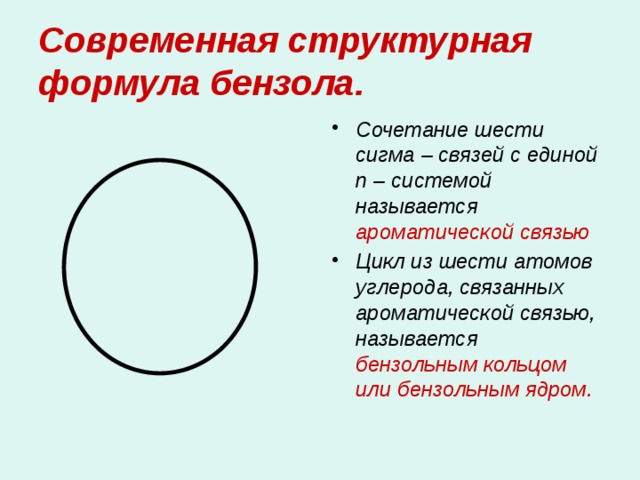
Современная структурная формула бензола.
- Сочетание шести сигма – связей с единой п – системой называется ароматической связью
- Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядром.










Получение
- Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
- В настоящее время бензол получают из нефти.
- Бензол получают синтетическими методами.
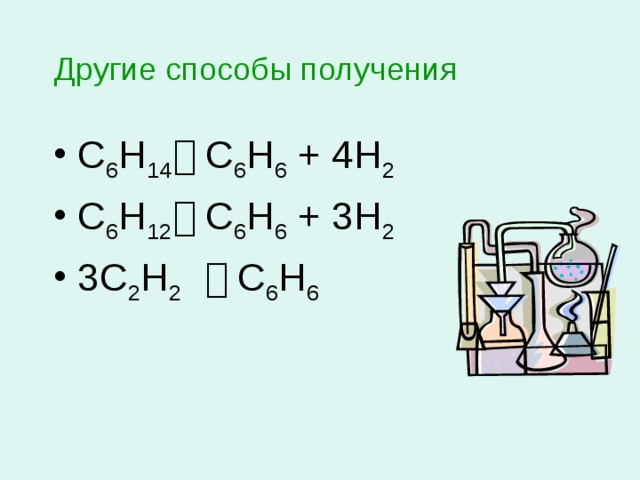
Другие способы получения
- С 6 Н 14 С 6 Н 6 + 4Н 2
- С 6 Н 12 С 6 Н 6 + 3Н 2
- 3С 2 Н 2 С 6 Н 6

Природные источники получения :
- Природные и попутные газы
- Нефть
- Каменный уголь

Физические свойства
- Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения +80 ºС и температурой плавления + 5ºС.
- Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней.
- Пары бензола с воздухом образуют взрывчатую смесь.
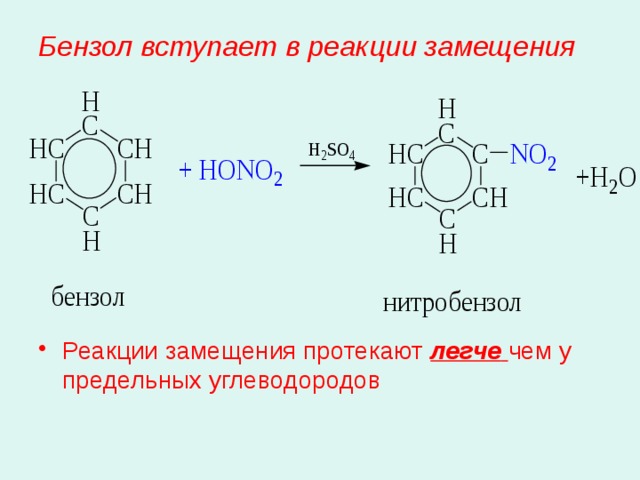
Бензол вступает в реакции замещения
- Реакции замещения протекают легче чем у предельных углеводородов
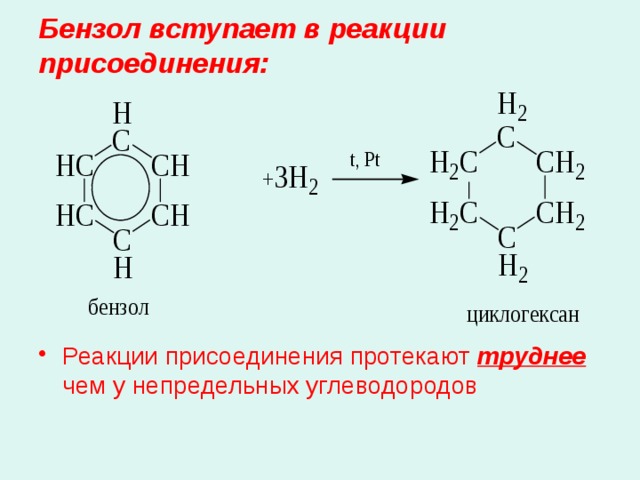
Бензол вступает в реакции присоединения:
- Реакции присоединения протекают труднее чем у непредельных углеводородов

Химические свойства
1.Горение бензола:
2С 6 Н 6 + 15О 2 = 12СО 2 + 6Н 2 О
2. Реакция замещения:
С 6 Н 6 + Br 2 C 6 H 5 Br + HBr
3. Нитрование:
С 6 Н 6 + НОNО 2 С 6 Н 5 NО 2 + Н 2 О
4. Гидрирование:
С 6 Н 6 + 3Н 2 С 6 Н 12
5. Хлорирование:
С 6 Н 6 + 3 Cl 2 C 6 H 6 Cl 6































































