
БЕЛКИ


Немного истории
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году сотрудником Мульдера Якобом Берцелиусом. В 1836 Мулдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C 16 H 24 N 4 0 5 , которая была названа протеин (Pr), а теория - теорией протеина. По мере накопления новых данных о белках теория неоднократно подвергалась критике, но до конца 1850-х оставалась общепризнанной.

Антуан Франсуа де Фуркруа , основоположник изучения белков

Первым установил строение белков в 1902г. выдающийся биохимик Эмиль Герман Фишер (1852-1919). В начале 60-х гг. пептидная теория Фишера была доказана синтезом полипептида состоящего из 18 аминокислот. Первым белком, первичную структуру которого удалось расшифровать, был инсулин. Они количественно преобладают над всеми другими органическими соединениями в живой клетке, на их долю приходится до 50% общей массы органических веществ животной клетки.

Элементарный состав
- Углерод – 50 – 55%
- Водород – 6,5 – 7,3%
- Азот – 15 – 18%
- Кислород – 21 – 24%
- Сера – до 2,4%
- И золы до 0,5 % (Р, Fе, Мg, Мn).

Аминокислотный состав
В состав белков входят
18 α-L-аминокислоты и два амида (протеиногенны)

Аминокислоты делятся на 7 групп по радикалу:
- Алифатические нейтральные аминокислоты – глицин, аланин, валин , лейцин , изолейцин ;
- Алифатические гидроксиаминокислоты - серин, треонин ;
- Серосодержащие аминокислоты – цистеин, метионин ;
- Кислые аминокислоты и их амиды – аспарагиновая кислота и ее амид аспарагин, глутаминовая кислота и ее амид глутамин;
- Основные аминокислоты – лизин , аргинин , гистидин ;
- Ароматические и гетероароматические аминокислоты – фенилаланин , тирозин, триптофан ;
- Циклические аминокислоты – пролин.
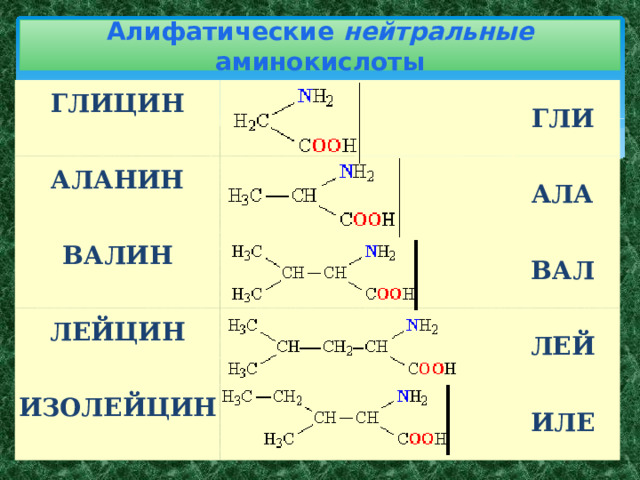
Алифатические нейтральные аминокислоты
ГЛИЦИН
АЛАНИН
ГЛИ
ВАЛИН
АЛА
ЛЕЙЦИН
ИЗОЛЕЙЦИН
ВАЛ
ЛЕЙ
ИЛЕ
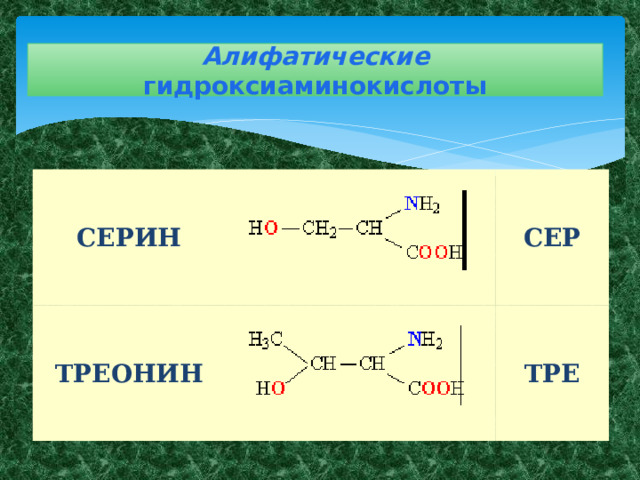
Алифатические гидроксиаминокислоты
СЕРИН
ТРЕОНИН
СЕР
ТРЕ
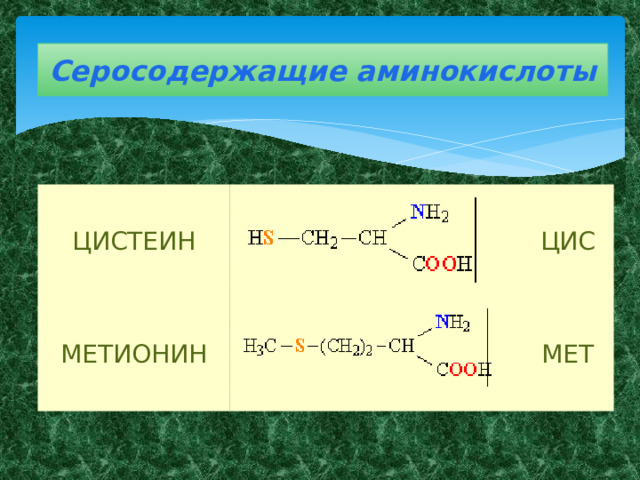
Серосодержащие аминокислоты
ЦИСТЕИН
МЕТИОНИН
ЦИС
МЕТ
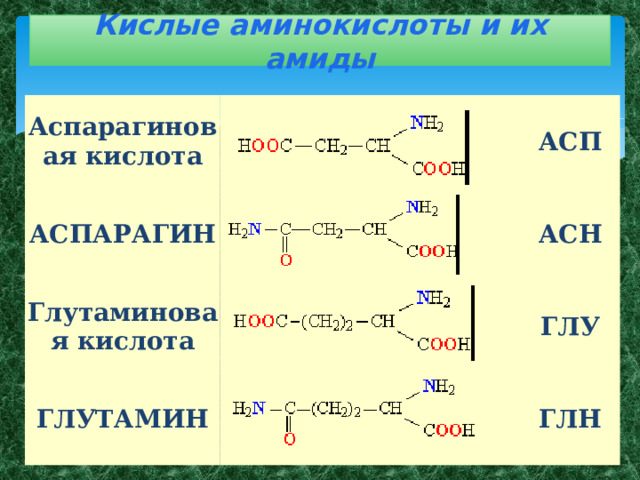
Кислые аминокислоты и их амиды
Аспарагиновая кислота
АСПАРАГИН
АСП
Глутаминовая кислота
АСН
ГЛУТАМИН
ГЛУ
ГЛН
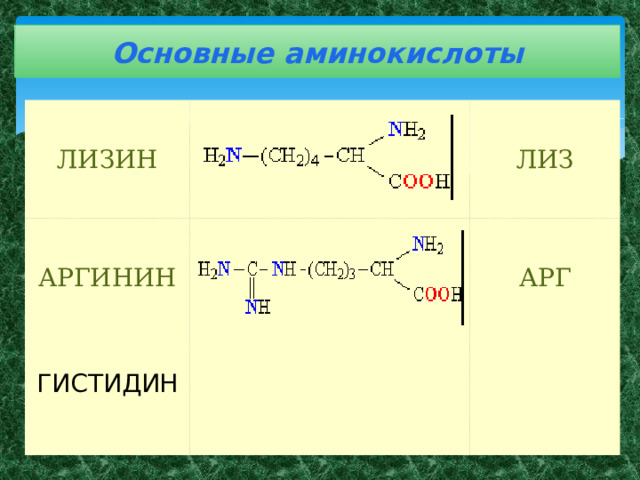
Основные аминокислоты
ЛИЗИН
АРГИНИН
ЛИЗ
АРГ
ГИСТИДИН

Растительные организмы синтезируют все 20 аминокислот, человек и животные не могут самостоятельно синтезировать 10 аминокислот (жирным шрифтом). Такие аминокислоты называются незаменимыми, и они обязательно должны входит в рацион животных и людей. В зависимости от аминокислотного состава белки делятся на полноценные и неполноценные белки
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.

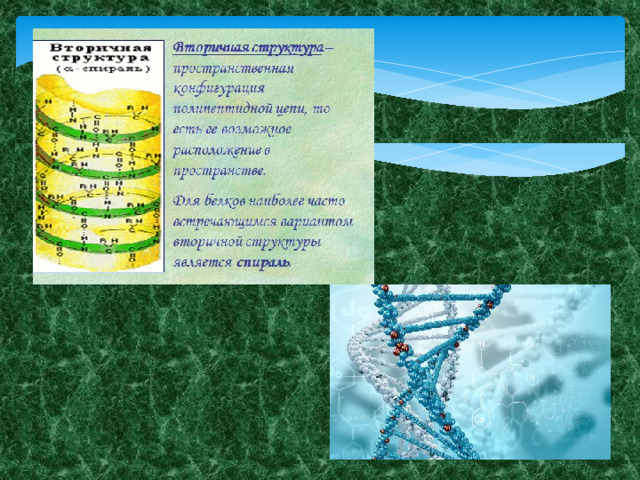
Структура белка
Белок всех организмов состоит из 20 видов аминокислот. Каждый Б. характеризуется определённым ассортиментом и количественным соотношением аминокислот. В молекулах Б. аминокислоты соединены между собой пептидными связями (—СО—NH—) в линейной последовательности, составляющей так называемую первичную структуру Б.


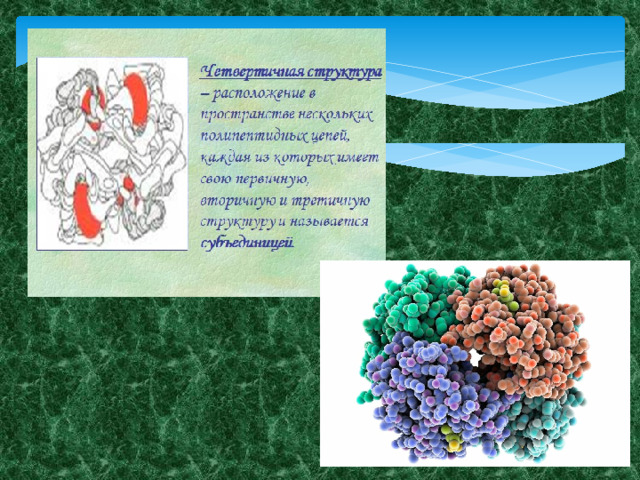

Классификация белков

Классификация белков
Классификация белков по форме молекулы
Фибриллярные - имеют вид пучка нитей. В отличие от глобулярных белков третичная структура состоит из трех вторичных структур свернутых в суперспираль
Глобулярные - имеют сферическую форму (глобулу) или стремятся к ней
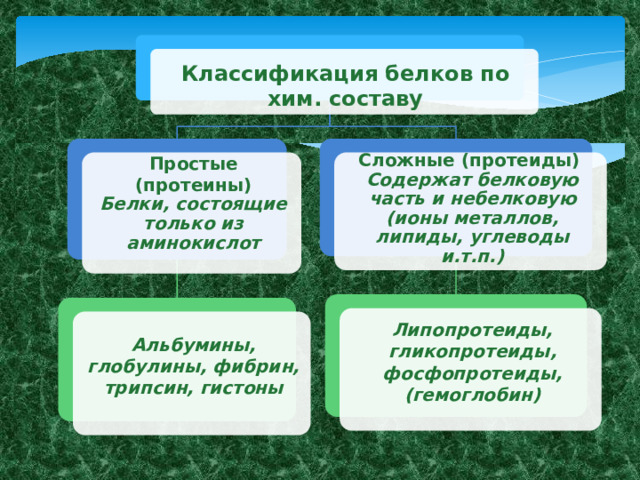
Классификация белков по хим. составу
Простые (протеины)
Сложные (протеиды)
Белки, состоящие только из аминокислот
Содержат белковую часть и небелковую (ионы металлов, липиды, углеводы и.т.п.)
Липопротеиды, гликопротеиды, фосфопротеиды, (гемоглобин)
Альбумины, глобулины, фибрин, трипсин, гистоны


Свойства белков
Химические свойства белков
- Горят со специфическим запахом жженого пера.
- Растворение в воде. Белки делятся на растворимые и нерастворимые в воде. С водой белки образуют коллоидные системы, они могут сильно набухать и образовывать студни.
- Денатурация – утрата белковой молекулой структурной организации, под влиянием некоторых факторов.
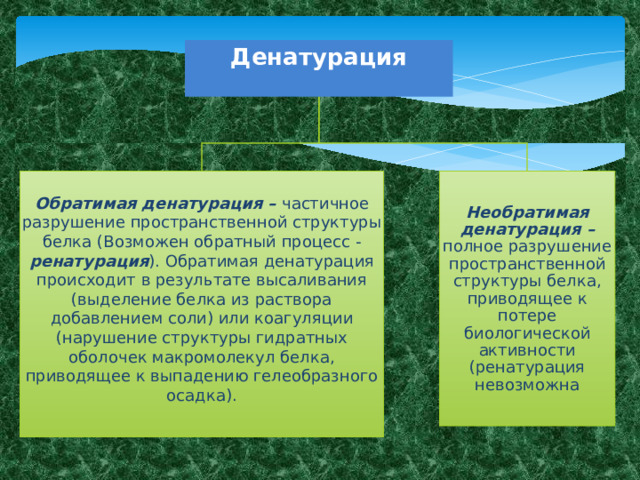
Денатурация
Обратимая денатурация – частичное разрушение пространственной структуры белка (Возможен обратный процесс - ренатурация ). Обратимая денатурация происходит в результате высаливания (выделение белка из раствора добавлением соли) или коагуляции (нарушение структуры гидратных оболочек макромолекул белка, приводящее к выпадению гелеобразного осадка).
Необратимая денатурация – полное разрушение пространственной структуры белка, приводящее к потере биологической активности (ренатурация невозможна

Денатурация происходит под действием:
- обезвоживания,
- резкого изменения рН среды (кислоты, щелочи),
- спиртов,
- солей тяжелых металлов,
- температуры,
- радиации,
- давления.
- Гидролиз – распад белка на аминокислоты. Гидролиз бывает: щелочным, кислотным, ферментативным
Н 2 О Н 2 О Н 2 О
Белок полипептиды олигопептиды дипептиды
Н 2 О
аминокислоты
- Подвергаются гниению (под действием гнилостных бактерий), при этом образуется СН 4 , Н 2 S, Н 3 N, Н 2 О и другие низкомолекуляные продукты

Цветные реакции на белок
№
1
Название
Биуретовая реакция
Реакция
2
Группы
Белок + NаОН + СuSО 4 → фиолетовое окрашивание
Ксантопро-теиновая реакция
3
4
Миллоновая реакция
На пептидную связь
Белок + НNО 3 → ярко-желтое окрашивание
На ароматические кольца
Сульфгид-рильная реакция
5
Белок + р-р Нg( О 3 ) 2 в НNО 3 → вишнево-красное окрашивание
Фенольные группировки
Белок + Рb(СН 3 СООН) 2 → черные осадок
Реакция Адамкевича
На – S – S – мостики
Белок + глиоксалевую кислоту + Н 2 SО 4(КОНЦ.) → фиолетовое окрашивание
На индольные группировки

Гидратация - способность белков прочно связывать значительное количество влаги; при этом они набухают, их масса и объём увеличиваются

Пенообразование – способность белков образовывать системы высокой концентрации «жидкость – газ». Их называют пенами.

Физические свойства белков
Агрегатное состояние
Твёрдые Жидкие
Форма молекул
Глобулярные белки Фибриллярные белки
Молекулы свёрнуты в Молекулы образуют
компактные глобулы длинные волокна
сферической или (фибриллы),
эллипсоидной формы. ассиметричны, прочны,
Растворимы в воде способны растягиваться.
образуют коллоидные Не растворимы в воде.
растворы. Коллаген – в сухожилиях;
- Антитела; Кератин – в коже, ногтях;
- Ферменты; Миозин – в мускулах.
- Гормоны;
- Гемоглобин.

Синтез белков
- В 1955 была выяснена структура инсулина. Вслед за этим была раскрыта первичная структура, рибонуклеазы, гемоглобина, трипсина и ряда других белков. Путём химического синтеза сначала были получены сложные пептиды со свойствами гормонов , затем удалось синтезировать гормон инсулин, наконец — фермент рибонуклеазу. Правильность химической формулы инсулина и рибонуклеазы подтвердилась тем, что синтетические белки не отличались от белков, продуцируемых организмом. Сейчас полностью или частично установлена структура свыше 200 белков.

Использование белков
- Белки широко используются в промышленности. Из белка состоят шерстяные и шелковые ткани, пластмасса галалит, кожа. Можно изготавливать ткани также из искусственных белковых нитей, получаемых из растительных белков. Например из семян лупина.

Значение белков.
Белки имеют большое значение, т.к. они входят в состав всех живых организмов. Эти биополимеры – носители жизни, основа живой клетки.
Трехмерная структура фермента лизоцима

ПРОДУКТЫ, СОДЕРЖАЩИЕ ЖИВОТНЫЕ БЕЛКИ

ПРОДУКТЫ, СОДЕРЖАЩИЕ РАСТИТЕЛЬНЫЕ БЕЛКИ
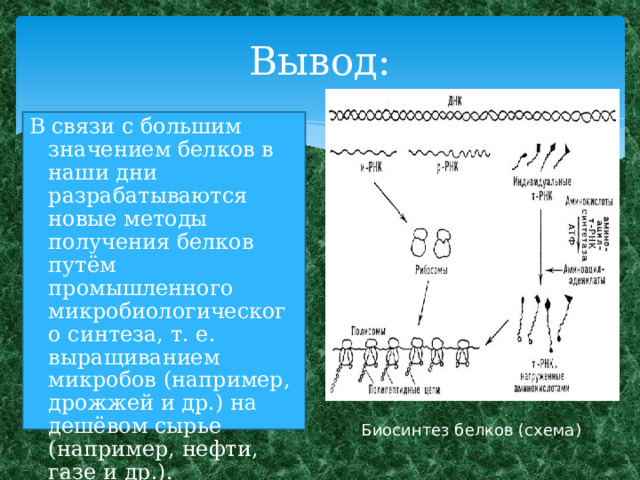
Вывод:
В связи с большим значением белков в наши дни разрабатываются новые методы получения белков путём промышленного микробиологического синтеза, т. е. выращиванием микробов (например, дрожжей и др.) на дешёвом сырье (например, нефти, газе и др.).
Биосинтез белков (схема)

Домашнее задание:
Прочитать § 38, выбрать один конкретный белок и сделать по нему реферат или презентацию. Внимание: повторяться белки не должны!






























































