Обобщающий урок в 8 классе по теме
«Основные классы неорганических соединений».
Цели: 1) формирование познавательных, коммуникативных, регулятивных универсальных учебных действий;
2) проверка степени усвоения основных понятий темы: оксиды, кислоты, основания, соли; химических свойств изученных веществ; контроль умения составлять уравнения химических реакций, определять их тип.
Задачи:
Обучающие: повторение, углубление и обобщение сведений об основных классах неорганических соединений: построение названий соединений, классификация.
Развивающие: развитие «химического» мышления, умения использовать терминологию, ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать информацию.
Воспитательные: формирование интереса к учению, стремления добиваться успеха в учебе за счет добросовестного отношения к своему труду, создание положительной психологической атмосферы, воспитание чувства взаимного уважения между ребятами для максимального раскрытия их способностей на уроке.
Результаты обучения:
Предметные:
Критический уровень: формулировать определения основных классов неорганических соединений, распознавать химические вещества по классам, давать названия веществам.
Достаточный уровень: владеть критическим уровнем; знать классификацию веществ внутри класса, объяснять принадлежность веществ к определённому классу, уметь самостоятельно составлять простейшие химические формулы веществ.
Творческий уровень: владеть достаточным уровнем, уметь самостоятельно решать экспериментальные задачи на идентификацию неорганических соединений.
Познавательные:
Критический уровень: ученик из указанного источника зафиксировал информацию и воспроизвёл её.
Достаточный уровень: ученик из нескольких источников зафиксировал информацию, сделал вывод и привёл хотя бы один аргумент для его подтверждения.
Творческий уровень: ученик самостоятельно организовал поиск информации, охарактеризовал основные источники, сделал вывод на основе анализа нескольких аргументов.
Коммуникативные:
Критический уровень: ученик отвечает на вопросы с помощью товарищей или учителя по заданному алгоритму.
Достаточный уровень: ученик самостоятельно дает односложные ответы по заданному алгоритму.
Творческий уровень: ученик самостоятельно дает развернутый аргументированный ответ, обобщает результаты.
Регулятивные:
Критический уровень: ученик понял цели и задачи деятельности, организовал свои действия с помощью товарищей или учителя, высказал своё мнение о проделанной работе.
Достаточный уровень: ученик сформировал цели и задачи с помощью учителя, спланировал и организовал свою деятельность по готовому алгоритму, оценил результат и процесс деятельности.
Творческий уровень: ученик самостоятельно сформировал цели и задачи деятельности, спланировал и организовал свою деятельность, сделал анализ результата и процесса деятельности.
Тип урока: урок – обобщение.
Техническое оборудование урока: компьютер, мультимедийный проектор.
Оборудование и реактивы: таблица Менделеева, таблица растворимости, пронумерованные пробирки с реактивами, индикатор метиловый оранжевый, оценочные листы.
Девиз урока: «Повторение – мать учения».
Ход урока.
Организационный момент. Приветствие учащихся. Проверка готовности к уроку.
Проверка домашнего задания.
На доске записано домашнее задание с ошибками. Ребята проверяют и исправляют ошибки.
Мотивация к учебной деятельности. Формулировка темы урока. Постановка целей.
Отгадайте загадки:
Два элемента в них всего-
Кислород важней всего. (оксиды)
Группы атомов о-аш -
Очень важный признак наш,
«Фенолфталеиновый» в нас
Становится малиновым. (основания)
Водород в состав их входит,
За собой остаток водит,
Они кислые на вкус
Их (кислотами) зовут.
Металл и кислотный остаток
В них дружно живут,
Эти вещества (солями) зовут.
Про что были эти загадки? (классы неорганических соединений) Сколько классов вы знаете? Мы уже изучили каждый класс веществ по отдельности. А что мы должны сделать сегодня на уроке? (обобщить полученные знания) Поэтому как будет звучать тема нашего урока? (основные классы неорганических соединений)
Какие вопросы мы должны рассмотреть, чтобы достичь поставленной цели?
Что такое оксиды, основания, кислоты, соли?
Какие они бывают?
Как правильно давать названия веществам разных классов?
Как составлять химические формулы веществ?
Как можно распознать вещества разных классов?
Организация деятельности.
Ребята, у вас на столах лежат оценочные листы, подпишите их, запишите тему урока и кратко цели, которые вы ставите для себя на этот урок. На уроке вы будете выполнять задания, и отмечать результаты своей работы в этих листах. Посмотрите, на отдельном листе у вас есть таблица самооценки. Вы должны напротив каждого задания поставить плюс в одной из клеток: выполнил работу самостоятельно, выполнил работу с помощью учителя или товарища, не справился с заданием. И в конце урока, оценив самостоятельно свои знания, вы будете знать какой раздел этой темы вам надо повторить или разобрать.
Осуществление деятельности.
Обучающиеся самостоятельно выполняют задания, опираясь на ранее полученные знания. После выполнения заданий, идет обсуждение полученных результатов.
Задание 1.
Допишите определения, вставив пропущенные слова:
Оксиды – это ________________ вещества, состоящие из _______ химических элементов, один из которых ____________________ .
Основания – это ___________ вещества, состоящие из атомов __________ , связанных с одной или несколькими ________________________________________ .
Кислоты – это ____________ вещества, молекулы которых состоят из атомов _________________ и _________________________________ .
Соли – это ____________ вещества, состоящие из атомов ______________ и _____________________________ .
Задание 2.
Пользуясь таблицей, распределите по классам следующие соединения:
H2S, P2O5, K2SO4, NaOH, H3РO4, CO2, Fe(OH)3, Al2О3, Mg3(PO4)2, KOH, HNO3, CuCl2, Ba(OH)2, Na2O, H2CO3, FeS.
| оксиды | основания | кислоты | соли |
|
|
|
|
|
Мы повторили определения, по определениям распределили данные вещества по классам, а теперь повторим классификацию соединений, выполнив задание 3.
Задание 3.
Заполните схемы и приведите примеры, используя соединения из задания 2:




Повторили классификацию оксидов, оснований и кислот. Теперь давайте вспомним как даются названия веществам.
Задание 4.
Установите соответствие между формулами соединений и их названиями.
| Формулы | Названия |
| 1. HCl 2. MgO 3. Al(NO3)3 4. SO3 5. H2SiO3 6. Fe(OH)2 7. Na2SO3 8. Ba(OH)2 | А. оксид серы (VI) Б. гидроксид железа (III) В. кремниевая кислота Г. оксид магния Д. гидроксид бария Е. нитрат алюминия Ж. гидроксид железа (II) З. сульфат натрия И. соляная кислота К. сульфит натрия |
Физминутка.
Учитель называет вещества, учащиеся выполняют соответствующее действие
(действия записаны на доске).
| класс соединений | действие |
| кислота | поднять правую руку |
| основание | поднять левую руку |
| кислотный оксид | правое ухо |
| основный оксид | левое ухо |
| соль | хлопок в ладоши |
Ca(OH)2, N2O5, HNO2, K3PO4, Pb(OH)2, Li2O, HCl, KNO3.
Перед тем, как мы повторим химические свойства классов неорганических веществ, давайте проведем небольшую практическую работу.
Задание 5.
Практическая работа.
В трех пробирках находятся бесцветные растворы:
Вариант 1 – серная кислота, гидроксид калия и сульфат натрия. Опытным путем докажите, в какой пробирке находится соль.
Вариант 2 – серная кислота, гидроксид калия и вода. Опытным путем докажите, в какой пробирке находится кислота.
Вариант 3 – серная кислота, гидроксид калия и вода. Опытным путем докажите, в какой пробирке находится щелочь.
О чём вы должны помнить при выполнении опытов? (Вспоминаем правила техники безопасности: кислоты и щёлочи, попав на кожу могут вызвать ожог. Осторожно!)
Обсуждение результатов.
Переходим к выполнению заданий 6 и 7, при выполнении которых мы повторим химические свойства всех классов неорганических соединений.
Задание 6.
Допишите уравнения реакций, расставьте коэффициенты и
определите тип реакции.
Аl + НCl = АlCl3 + ….
…+ О2 = МgО
Н2О + …. = H2SO4
Сu(ОН)2 +…. = СuCl2 + Н2О
СаСО3 = …. + СО2
Задание 7.
Осуществите превращения и назовите все соединения.
Mg → MgO → MgCl2 → Mg(OH)2 → MgO
Задание 8.
Решите задачу.
Рассчитайте массу оксида калия, необходимого для получения 37г гидроксида калия.
Подведение итогов.
Теперь мы с вами подведем итоги. Ребята, вы сегодня хорошо поработали, всем большое спасибо! В конце нашего урока, я предлагаю вам оценить свою работу. Для этого заполните, пожалуйста, таблицу и посмотрите в какой колонке у вас больше всего плюсов. Сделайте вывод, что из пройденного материала вам надо повторить.
Выставление оценок.
Домашнее задание: подготовиться к контрольной работе, повторить §30 – 33, решить задания на листике.
Заполните таблицу самооценки, поставив + там, где вы считаете нужным.
| номер задания | тема задания | я самостоятельно выполнил(а) это задание | мне потребовалась помощь учителя или одноклассника | я не справился(ась) с этим заданием |
| 1 | определение класса |
|
|
|
| 2 | распознавание соединений по классам, согласно определению |
|
|
|
| 3 | классификация оксидов, оснований и кислот |
|
|
|
| 4 | названия веществ |
|
|
|
| 5 | опытное определение данных веществ |
|
|
|
| 6 | дописать уравнения реакций |
|
|
|
|
| расставить коэффициенты |
|
|
|
| 7 | написать соответствующие реакции |
|
|
|
|
| дать названия веществам |
|
|
|
| 8 | составление уравнения реакции |
|
|
|
|
| решение задачи |
|
|
|
Домашнее задание.
Подготовиться к контрольной работе, повторить §30 – 37
Задание 1. Допишите уравнения реакций, расставьте коэффициенты и
определите тип реакции.
СuО + ….. = Сu SO4 + Н2О
Аl2(SO4)3 + ВаCl2 = ……+ АlCl3
К2О + … = КОН
Na + Cl2 = ….
Fе2(SO4)3 + …. = Fе(ОН)3 + Na2SO4
KOH + …= КCl + H2O
Задание 2. Осуществите превращения.
P →P2O 5→Н3 РО4 → Са3 (РО4)2→ СаSO4
Zn→ ZnO →ZnSO4 →Zn(OH)2 →ZnO
Задание 3. Решите задачу.
Какова масса соляной кислоты, вступившей в реакцию с 16г цинка.
Какова масса соли полученной при взаимодействии азотной кислоты с 28г оксида кальция.
Ф.И. ____________________________________ Дата ____________
Тема урока: ________________________________________________________________________
___________________________________________________________________________________
Цели урока: ________________________________________________________________________
Задание 1.
Допишите определения, вставив пропущенные слова:
Оксиды – это ________________ вещества, состоящие из _______ химических элементов, один из которых ____________________ .
Основания – это ___________ вещества, состоящие из атомов __________ , связанных с одной или несколькими ________________________________________ .
Кислоты – это ____________ вещества, молекулы которых состоят из атомов _________________ и _________________________________ .
Соли – это ____________ вещества, состоящие из атомов ______________ и _____________________________ .
Задание 2.
Пользуясь таблицей, распределите по классам следующие соединения:
H2S, P2O5, K2SO4, NaOH, H3РO4, CO2, Fe(OH)3, Al2О3, Mg3(PO4)2, KOH, HNO3, CuCl2, Ba(OH)2, Na2O, H2CO3, FeS.
| оксиды | основания | кислоты | соли |
|
|
|
|
|
Задание 3.
Заполните схемы и приведите примеры, используя соединения из задания 2:

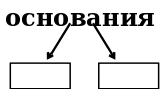


Задание 4.
Установите соответствие между формулами соединений и их названиями.
| Формулы | Названия |
| 1. HCl 2. MgO 3. Al(NO3)3 4. SO3 5. H2SiO3 6. Fe(OH)2 7. Na2SO3 8. Ba(OH)2 | А. оксид серы (VI) Б. гидроксид железа (III) В. кремниевая кислота Г. оксид магния Д. гидроксид бария Е. нитрат алюминия Ж. гидроксид железа (II) З. сульфат натрия И. соляная кислота К. сульфит натрия |
Задание 5. Практическая работа.
_______________________________________________________________
Задание 6.
Допишите уравнения реакций, расставьте коэффициенты и
определите тип реакции.
Аl + НCl = АlCl3 + ….
..…+ О2 = МgО
Н2О + …... = H2SO4
Сu(ОН)2 +……. = СuCl2 + Н2О
СаСО3 = …... + СО2
Задание 7.
Осуществите превращения и назовите все соединения.
Mg → MgO → MgCl2 → Mg(OH)2 → MgO
________________________________________________________
________________________________________________________
________________________________________________________
________________________________________________________
Задание 8.
Решите задачу.
Рассчитайте массу оксида калия, необходимого для получения 37г гидроксида калия.
|
Задание 5. Практическая работа.
В трех пробирках находятся бесцветные растворы: Вариант 1 – серная кислота, гидроксид калия и сульфат натрия. Опытным путем докажите, в какой пробирке находится соль.
|
Задание 5. Практическая работа.
В трех пробирках находятся бесцветные растворы: Вариант 2 – серная кислота, гидроксид калия и вода. Опытным путем докажите, в какой пробирке находится кислота.
|
|
Задание 5. Практическая работа.
В трех пробирках находятся бесцветные растворы: Вариант 3 – серная кислота, гидроксид калия и вода. Опытным путем докажите, в какой пробирке находится щелочь.
|
Задание 5. Практическая работа.
В трех пробирках находятся бесцветные растворы: Вариант 1 – серная кислота, гидроксид калия и сульфат натрия. Опытным путем докажите, в какой пробирке находится соль.
|
|
Задание 5. Практическая работа.
В трех пробирках находятся бесцветные растворы: Вариант 2 – серная кислота, гидроксид калия и вода. Опытным путем докажите, в какой пробирке находится кислота.
|
Задание 5. Практическая работа.
В трех пробирках находятся бесцветные растворы: Вариант 3 – серная кислота, гидроксид калия и вода. Опытным путем докажите, в какой пробирке находится щелочь.
|

































