Тема «Вода, растворы. Теория электролитической диссоциации»
Лабораторная работа № 1.
Приготовление растворов с определенными концентрациями
Учебная цель: научиться определять концентрацию раствора, исходя из количеств компонентов; готовить растворы заданной концентрации.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- способы выражения концентрации растворов.
Обучающийся должен уметь:
- проводить расчеты по нахождению определенной концентрации раствора.
Задачи практического занятия:
Закрепить теоретические знания о растворах и способах выражения концентрации.
Ответить на вопросы для закрепления теоретического материала.
Закрепить практику приготовления раствора заданной концентрации.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Оборудование:
технические весы, стакан, стеклянная палочка, мерный цилиндр, мерная колба на 100 мл.
Реактивы:
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме лабораторной работы
Растворами называют гомогенные смеси, состоящие из двух или более компонентов.
Растворитель это компонент раствора, агрегатное состояние которого не изменяется при образовании раствора, или содержимое которого преобладает над содержанием других компонентов. Компонентами раствора являются: растворитель и растворенное вещество.
Однако иногда трудно сказать, вещество является растворителем или растворенным веществом, особенно когда оба вещества взаимно растворяются друг в друге в неограниченном количестве (как спирт и вода). В таких случаях растворителем называют то вещество, которого в растворе больше.
Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным.
Понятно, что раствор, в котором содержится меньше растворенного вещества, чем в насыщенном, называют ненасыщенным. Некоторые вещества способны образовывать пересыщенные растворы. Однако это довольно нестабильные жидкости: если их встряхнуть или потереть стеклянной палочкой о внутреннюю стенку сосуда, избыток растворенного вещества выпадает в осадок.
Содержание вещества в насыщенном растворе может служить мерой его растворимости. Как правило, растворимость (или коэффициент растворимости) выражают в граммах вещества в 100 г растворителя (например, воды). Если растворимость превышает 1 г в 100 г воды, вещество считается растворимым, от 0,1 до 1,0 г малорастворимым. Вещества растворимостью менее 0,1 г в 100 г воды условно называют нерастворимыми.
По отношению к растворам часто употребляют термины «концентрированный» и «разбавленный». Понятия эти весьма относительные. Если раствор содержит большое количество растворенного вещества, его называют концентрированным. Раствор с небольшим содержанием растворенного вещества называют разбавленным. Как правило, концентрированными или разбавленными называют растворы хорошо растворимых в растворителе веществ.
Твердые вещества, которые в своем составе содержат молекулы воды, называют кристаллогидратами.
Содержание растворенного вещества в растворе называют концентрацией.
Массовой долей растворенного вещества (В) называют отношение массы растворенного вещества (В) к массе раствора (mр-ра):
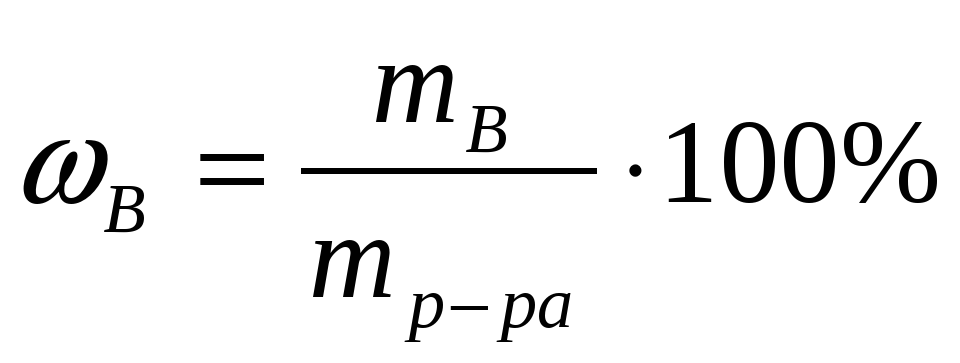 (1)
(1)
Это понятие аналогично массовой доле вещества в любой смеси, как гетерогенной, так и гомогенной. Массовую долю растворенного вещества выражают в процентах (от 0 до 100%) или долях единицы (от 0 до 1).
Очевидно, что масса раствора mр-ра складывается из массы растворителя mр-ля и массы растворенного вещества mB:
mp-ра = mB + mр-ля (2)
Отмерять жидкости взвешиванием не очень удобно, гораздо проще отмерять нужный объем. Чтобы рассчитать массу известного объема V раствора, необходимо знать его плотность :
mp-ра = V (3)
Как правило, плотность раствора измеряют в граммах на миллилитр (г/мл) или граммах на кубический сантиметр (г/см3), причем численно эти значения равны, поскольку 1 мл это объем, равный 1 см3. Необходимо помнить, что плотность чистой воды равна 1 г/мл.
Другим вариантом оценки концентрации раствора является молярная концентрация.
Молярная концентрация количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации СМ, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Расчет молярной концентрации осуществляют по формуле:
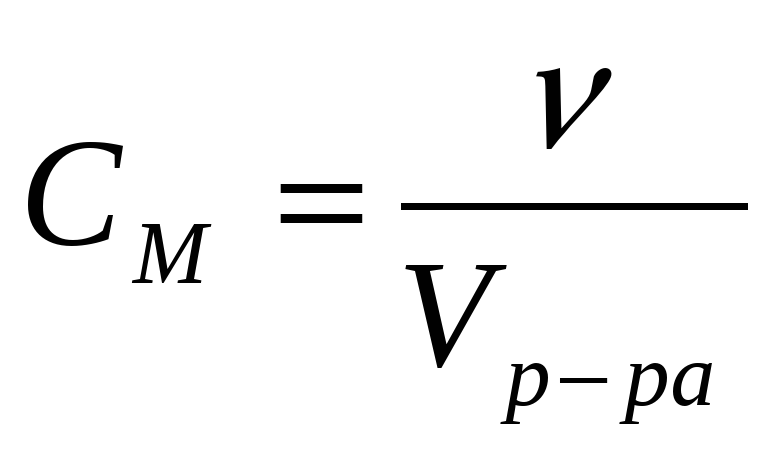 (4)
(4)
где количество растворенного вещества, моль;
V общий объём раствора, л.
Вопросы для закрепления теоретического материала к лабораторной работе
Что называется раствором?
Что называется растворителем?
Что такое концентрированный раствор?
Что такое насыщенный раствор?
Задания для лабораторного занятия:
Выполнить предложенные задания.
Результаты расчета при приготовлении растворов записать в таблицу 1.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
| Вариант 1 | Вариант 2 |
| Приготовить 80 г 10% раствора поваренной соли. | Приготовить 40 г 5% раствора поваренной соли. |
Порядок выполнения задания
1. Рассчитайте массу растворенного вещества и растворителя.
На весах взвесьте нужное количество растворенного вещества.
Мерным цилиндром отмерьте нужный объем воды, считая, что плотность воды равна 1 г/мл.
Пересыпьте растворяемое вещество в стакан, прилейте воду, размешайте до полного растворения вещества.
Записываем результаты расчета для приготовления раствора в таблицу 1.
Задание 2
| Вариант 1 | Вариант 2 |
| Приготовить раствор объемом 100 мл пищевой соды, если молярная концентрация равна 0,1 моль/л. | Приготовить раствор объемом 100 мл пищевой соды, если молярная концентрация раствора 0,2 моль/л. |
Порядок выполнения задания
1. Рассчитайте массу растворенного вещества.
На весах взвесьте нужное количество растворенного вещества.
В мерную колбу на 100 мл всыпаем расчетное количество вещества.
Доводим дистиллированной водой до 100 мл.
Перемешиваем до полного растворения вещества.
Записываем результаты расчета для приготовления раствора в таблицу 1.
Отчитаться о выполненной работе преподавателю.
Таблица 1
Расчет растворенного вещества и растворителя для приготовления раствора заданной концентрации
| № задания | Дано | Расчет по формуле |
| Вариант |
| 1 | (%) = р-ля = 1 г/см3
| mB = |
| 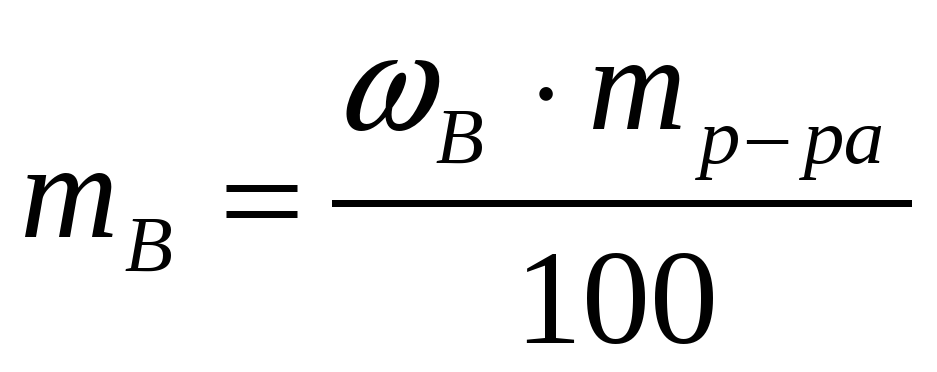 |
| mр-ля = |
| mp-ля = mр-ра - mВ |
| Vр-ля = |
| 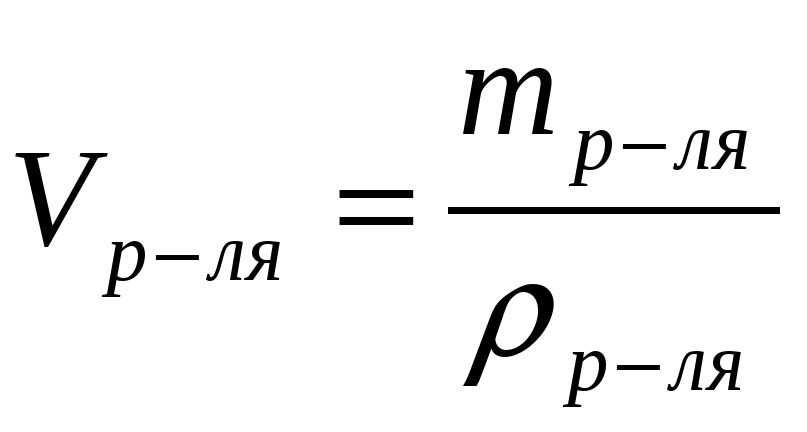 |
| 2 | СМ = Vр-ра = 100 мл | mB = |
| 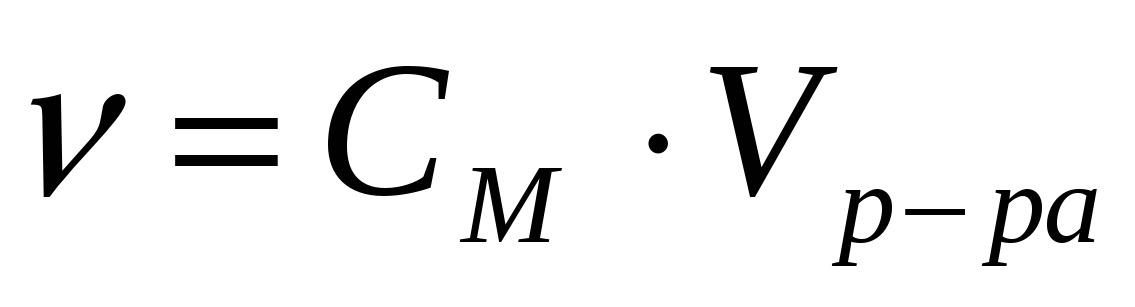 mB = М, где М молярная масса вещества |
Вопросы для контроля
Что такое растворимость?
Что такое концентрация растворов?
Что такое массовая доля растворенного вещества?
Что такое молярная концентрация?
Форма контроля выполнения лабораторной работы:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».

























