Урок химии в 9-м классе по теме "Угольная кислота и её соли" Тип урока: изучение и первичное закрепление новых знаний.
Цели:
Образовательная:
создание условий для закрепления знаний о средних и кислых солях на примере карбонатов и гидрокарбонатов, их взаимопревращениях. Изучение качественной реакции на карбонат – ион;
Развивающая:
развитие познавательной активности и самостоятельности учащихся;
формирование исследовательских навыков.
Воспитательная:
Методы обучения:
проблемный
исследовательский.
Организационные формы:
фронтальная
индивидуальная
работа в парах
Оборудование:
набор реактивов для проведения опытов,
компьютерная презентация,
образцы минералов, скелеты раковин.
Эпиграф к уроку : «…У школьного мела, у стен дворца и у стен пирамиды один источник, одна основа….»
Ход урока
Оргмомент
Приветствие: Я рада встрече с вами. Сегодня мы продолжим изучение соединений углерода. Перед началом урока я пожелаю вам хорошего настроения и творческих успехов, надеюсь, что наша встреча пройдёт плодотворно.
Актуализация знаний
Учитель: 1. Какие соединения образует углерод?
Учащиеся составляют схему: «Соединения углерода» ( приложение1, слайд)

2.Как называется ряд, составленный из следующих формул веществ?
C → CO→ CO2→H2CO3→CaCO3
(Ответ учащихся: генетический ряд углерода)
У доски учащийся выполняет индивидуальное задание: записывает уравнения реакций переходов.
3.Какие соединения углерода мы уже изучили? ( Ответ: оксиды углерода)
4. А какие соединения предстоит изучить? (Ответ: угольную кислоту и её соли)


Учитель: Открывая бутылку лимонада, “Пепси-колы” или любого другого газированного напитка мы сталкиваемся с нашей незнакомкой. Это она, угольная кислота. Как часто предательски вырывается она из бутылки, разбрызгиваясь вокруг. Это происходит от того, что молекулы её крайне неустойчивы, а в бутылке она находится под большим давлением, когда мы открываем крышку , она сразу разлагается:
H2CO3=H2O + CO2
Угольная кислота- это тот редкий случай вещества, формулу которого принято считать условной, т. е. такой молекулы не существует, однако возможно рассматривать не только свойства её соединений, но и собственные свойства этой кислоты.
Записываем тему урока : «Угольная кислота и ее соли » ( приложение1, слайд )

Изучение нового материала
(Постановка проблемного вопроса)
Учитель: 
Учащиеся предлагают варианты ответов и выбирают правильный.
Видеоролик «Получение угольной кислоты» ( приложение1, слайд )
Вопросы учащимся после просмотра видеоролика:
1.Что наблюдаете? 2.Как изменяется окраска лакмуса? 3.Почему?
4.Какой вывод о силе угольной кислоты можно сделать?
(Если учащиеся затрудняются с выводом о силе кислоты, то можно для сравнения представить им окраску лакмуса в растворе соляной кислоты).
Вывод: угольная кислота является слабой, что подтверждает розовая окраска лакмуса, а не красная, как в растворах сильных кислот.
Учащиеся объясняют наблюдаемые явления и записывают уравнение реакции получения угольной кислоты, ( приложение1, слайд)

Характеристика угольной кислоты составляется в ходе беседы с классом. Учащиеся классифицируют угольную кислоту по известным признакам, записывают уравнения диссоциации по ступеням.

Учитель:так как угольная кислота двухосновная, то ей состветствуют соли двух типов. Какие? ( приложение1, слайд)
Соли
Средние Кислые
CaCO3 Ca(HCO3)2
Дайте названия этим солям
(Карбонат кальция ) (Гидрокарбонат кальция)
Что можно сказать о растворимости карбонатов? (работа с таблицей растворимости: растворимы только соли K+, Na+, NH4+ )
А гидрокарбонаты ? ( растворимы все) ( приложение1, слайд)
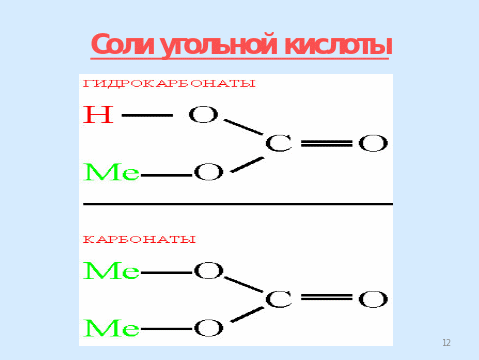
Учитель: Особенностью солей угольной кислоты является их способность превращаться друг в друга (демонстрация видеоролика «Взаимопревращения карбонатов и гидрокарбонатов»- приложение1, слайд)
Какой вывод можно сделать из наблюдаемых явлений?: (в избытке кислоты карбонаты превращаются в гидрокарбонаты, а при нагревании - наоборот).
(учащиеся составляют уравнения реакций)

Учитель: химические реакции мы привыкли наблюдать в школьной лаборатории, в пробирках. Но такие же процессы происходят и в природе, вокруг нас. Об этом нам сейчас расскажет Никифоров Андрей( сообщение учащегося об образовании карстовых пещер), (приложение 1,слайд )
Учитель : На ваших столах находятся образцы мела, мрамора, известняка. Здесь вы видите также ракушки. (приложение 1, слайд )
Что общего между этими горными породами и минералами и объектами живой природы? Чтобы ответить на эти вопросы предлагаю вам выполнить лабораторный опыт. (Инструкция по ТБ)
Лабораторный опыт:
1.К бразцам мела, мрамора, известняка, ракушек добавьте по каплям HCl.
2. Что наблюдаете?
3. Как вы думаете, какое вещество входит в их состав?
(учащиеся высказывают предположение: карбонаты)
Учитель: действительно, основной компонент этих объектов живой и неживой природы- карбонат кальция. Не случайно в своей поэме о минералах Н.М.Федоровский написал:
По формуле, как не смотри,
Они не рознятся никак:
Все те же кальций це о три,
Как мрамор, так и известняк. ( приложение 1, слайд )
Таким образом можно распознать соли угольной кислоты среди других солей. Это качественная реакция на карбонаты и гидрокарбонаты)

Учитель. Вам никогда не приходило задуматься о том, почему, желая дать какому-то произведению искусства оценку, говорят: «Это-жемчужина…». А далее уже называют вид искусства. Но почему жемчужина? А потому, что жемчуг всегда считался символом высочайшего проявления прекрасного. Так что же такое жемчуг? (сообщение учащегося –Набатчикова Владимира, слайды приложение 1)
Закрепление полученных знаний
Учитель: я думаю, вы уже поняли, что соли угольной кислоты широко распространены в природе и участвуют во многих химических процессах. А теперь я предлагаю вам закрепить изученное.

 (плюсы)
(плюсы)
Выполнение теста:

 (сколько плюсов)
(сколько плюсов)
Подведение итогов
Учитель: Давайте подведем итог. Угольная кислота и ее соли во многом формируют облик планеты. Они находят широкое применение и в хозяйственной деятельности человека. Особое значение в истории цивилизации имеет карбонат кальция. Это ему мы обязаны архитектурным обликом наших городов. Но для того, чтобы карбонаты работали на человека, требуется знание научных закономерностей, в первую очередь химических процессов, протекающих вокруг нас. И бережное отношение к природе.
Оценивание учащихся, Д/З. (п.28, 27; упр.16-18, з.3.,
Т.З. Составление синквейна на тему «Угольная кислота и её соли»
1 существительное
2 прилагательных
3 глагола
1 предложение
1 слово
















 (плюсы)
(плюсы)
 (сколько плюсов)
(сколько плюсов)

















