
Презентация по химии на тему: «Кислоты, их классификация и свойства».
Автор: учитель химии МАОУ «СОШ №21»
г. Миасса Челябинской области
Краснокутская Т.Ю.

Определения кислот:
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Кислоты – это электролиты, состоящие из катионов водорода и анионов кислотного остатка.
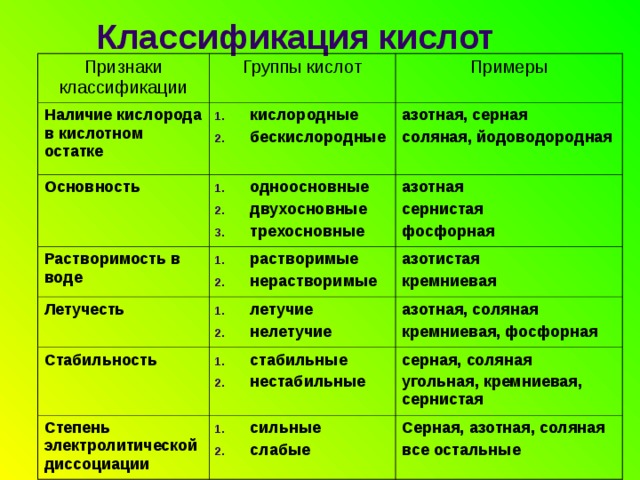
Классификация кислот
Признаки классификации
Группы кислот
Наличие кислорода в кислотном остатке
Основность
Примеры
- кислородные
- бескислородные
Растворимость в воде
- одноосновные
- двухосновные
- трехосновные
азотная, серная
соляная, йодоводородная
азотная
сернистая
фосфорная
- растворимые
- нерастворимые
Летучесть
азотистая
кремниевая
Стабильность
азотная, соляная
кремниевая, фосфорная
Степень электролитической диссоциации
серная, соляная
угольная, кремниевая, сернистая
Серная, азотная, соляная
все остальные

Классификация кислот по составу.
Кислородсодержащие кислоты
Бескислородные кислоты
H 2 SO 4 серная кислота
H 2 SO 3 сернистая кислота
HNO 3 азотная кислота
H 3 PO 4 фосфорная кислота
H 2 CO 3 угольная кислота
H 2 SiO 3 кремниевая кислота
HF фтороводородная кислота
HCl хлороводородная кислота (соляная кислота)
HBr бромоводородная кислота
HI йодоводородная кислота
H 2 S сероводородная кислота

Классификация кислот по основности
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на
одноосновные - (с одним атомом водорода),
двухосновные - (с 2 атомами водорода)
и трехосновные - (с 3 атомами водорода).

К И С Л О Т Ы
Одноосновные
Двухосновные
HNO 3 азотная
HF фтороводородная
HCL хлороводородная
HBr бромоводородная
HI йодоводородная
H 2 SO 4 серная
H 2 SO 3 сернистая
H 2 S сероводородная
H 2 CO 3 угольная
H 2 SiO 3 кремниевая
Трехосновне
H 3 PO 4 фосфорная

"одноосновная кислота"
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
- HNO 3 + NaOH = NaNO 3 + H 2 O
- HCl + KOH = KCl + H 2 O

"двухосновная и трехосновная"
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
- H 2 SO 4 + 2 NaOH = Na 2 SO 4 + 2 H 2 O
- H 3 PO 4 + 3 NaOH = Na 3 PO 4 + 3 H 2 O

Задание: Дайте характеристику кислоте, используя различные признаки классификации кислот

Типичные химические реакции кислот
- 1. кислота + основание = соль + вода
- 2. кислота + оксид металла = соль + вода
- 3. кислота + металл = соль + водород
- 4. кислота + соль = новая кислота + новая соль

1. Действие растворов кислот на индикаторы
Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов . По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.

2. Взаимодействие кислот с основаниями
Эта реакция называется реакцией нейтрализации . Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Например:
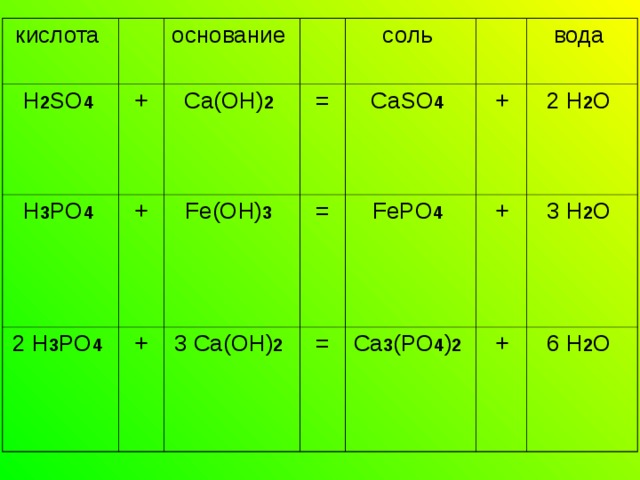
кислота
H 2 SO 4
H 3 PO 4
+
основание
2 H 3 PO 4
+
Ca(OH) 2
+
=
Fe(OH) 3
соль
3 Ca(OH) 2
=
CaSO 4
+
вода
FePO 4
=
Ca 3 (PO 4 ) 2
+
2 H 2 O
3 H 2 O
+
6 H 2 O

3. Взаимодействие кислот с основными оксидами
Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду.
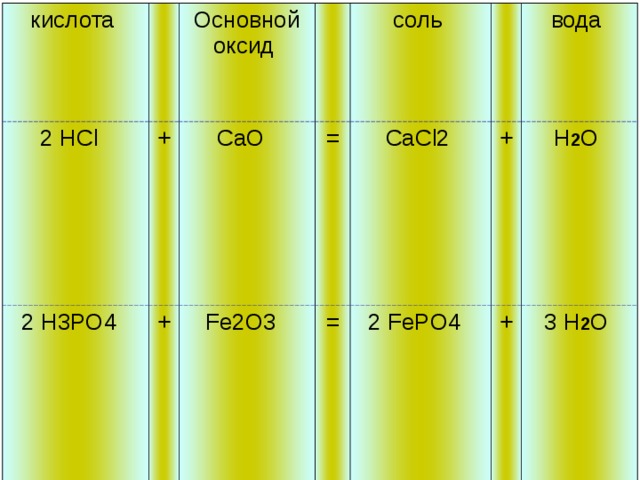
кислота
2 HCl
+
Основной оксид
2 H3PO4
CaO
+
Fe2O3
соль
=
CaCl2
=
2 FePO4
+
вода
H 2 O
+
3 H 2 O

4. Взаимодействие кислот с металлами
Для взаимодействия кислот с металлом должны выполняться некоторые условия.
1. Металл должен находиться в электрохимическом ряду напряжения металлов до водорода.
2. Должна получиться растворимая соль.
3. В реакцию должна вступать растворимая кислота.
4. Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации взаимодействуют с металлами с образованием других продуктов
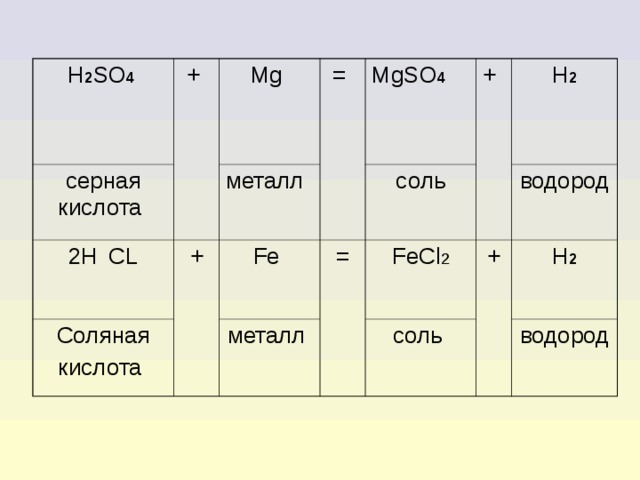
H 2 SO 4
серная кислота
+
2H С L
Mg
=
металл
+
Соляная
кислота
MgSO 4
Fe
соль
+
=
металл
FeCl 2
H 2
водород
+
соль
H 2
водород
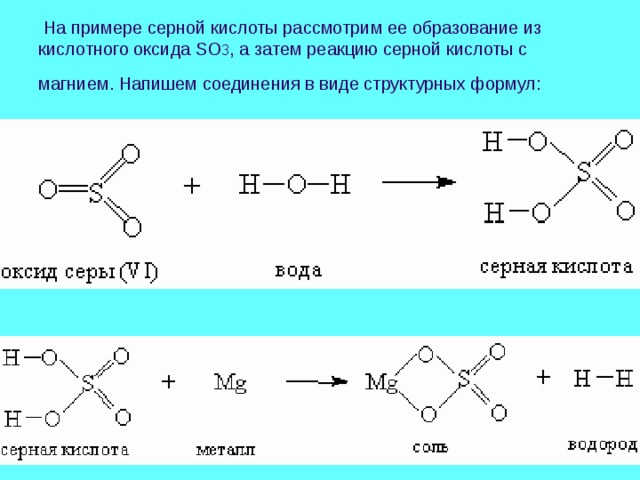
На примере серной кислоты рассмотрим ее образование из кислотного оксида SO 3 , а затем реакцию серной кислоты с магнием. Напишем соединения в виде структурных формул:

Задание: Выберите возможные химические реакции.
- Оксид магния + азотная кислота =
- Серебро + соляная кислота +
- Гидроксид кальция + фосфорная кислота =
- Никель + сероводородная кислота =
- Цинк + серная кислота (раствор) =
- Оксид углерода (IY) + соляная кислота =
- Соляная кислота + карбонат натрия =
- Кремниевая кислота + магний =

Всем спасибо!
Успехов в учебе!












































