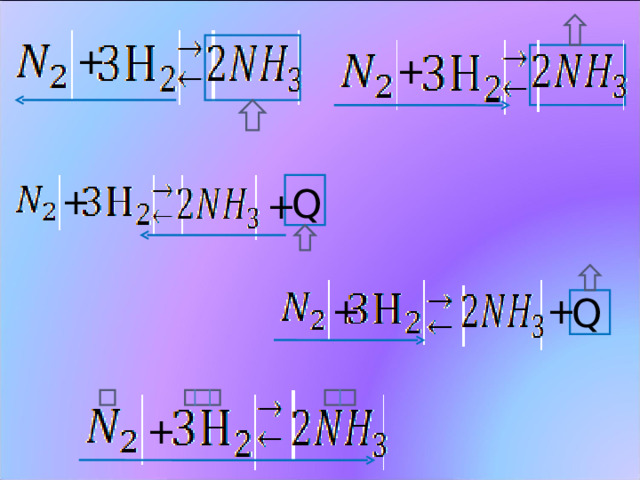Просмотр содержимого документа
«Химическое равновесие. Условия его смещения.»


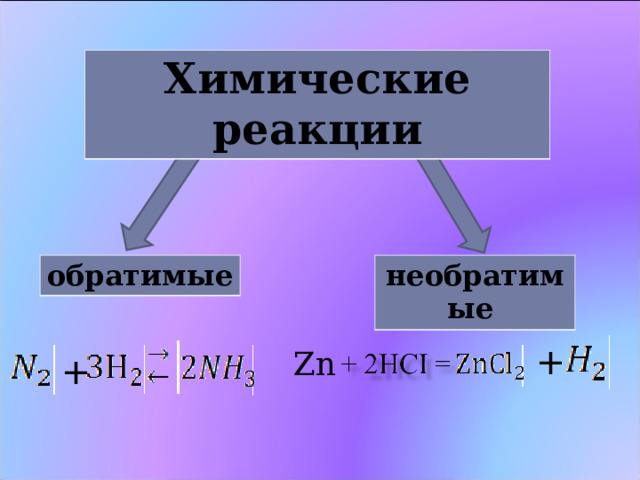
Химические реакции
обратимые
необратимые
+
Zn
+

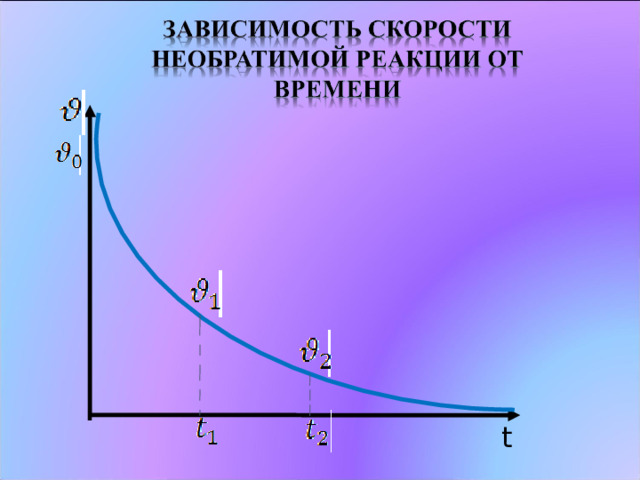
Химические реакции, протекающие в одном направлении, называются необратимыми
Химические реакции, протекающие при одних и тех же условиях одновременно в двух противоположных направлениях, называются обратимыми
t
V
=
Химическое
равновесие
t

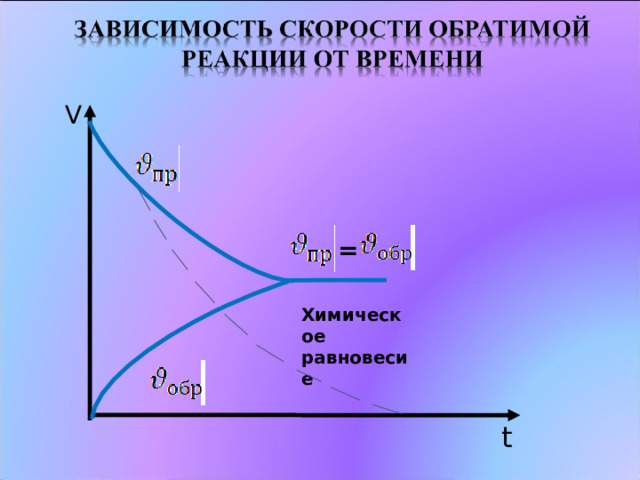
Химическое равновесие – это такое состояние
системы, при котором скорость прямой
реакции равна скорости обратной реакции .
Химическое равновесие – подвижное (динамическое)
Состояние химического равновесия сохраняется до
тех пор, пока остаются неизменными условия реакции: концентрация, температура и давление

ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ НА СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
+
При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции (вправо)
+
При увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции (влево)
Изменение массы твердого вещества не изменяет положение равновесия
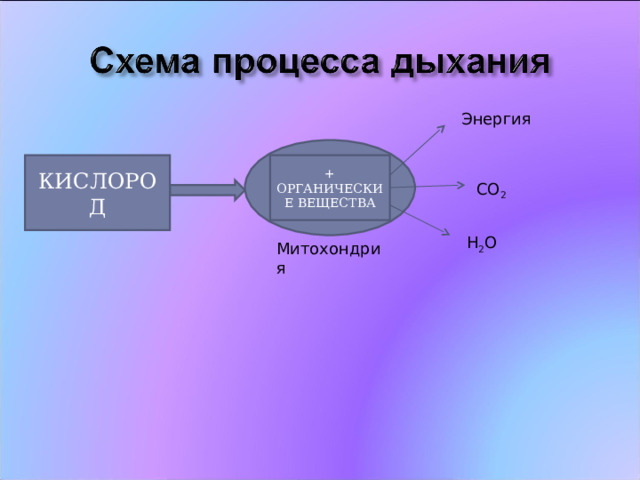
Энергия
КИСЛОРОД
+ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
CO 2
H 2 O
Митохондрия

ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Q
+
Q
+
+
+
При увеличении температуры равновесие всегда смещается в
сторону эндотермической реакции
T
T
Q
Q
Q
- выделение или поглощение теплоты в ходе прямой реакции
и
Q
- внешние температурные воздействия на систему
T
T
и

ВЛИЯНИЕ ДАВЛЕНИЯ НА СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
+
+
При увеличении давления равновесие смещается в сторону той
реакции, которая приводит к уменьшению объёмов газообразных
Веществ (только для газообразных веществ)
P
P
- Увеличение или уменьшение числа молей газов в системе в ходе прямой реакции
и
P
P
и
- Увеличение и уменьшение внешнего давления на систему

ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ:
- Концентрация реагентов
- Температура
- Давление

ПРИНЦИП ЛЕ ШАТЕЛЬЕ:
в равновесной системе при изменении внешних условий химическое равновесие смещается в сторону той реакции, которая противодействует произведенному изменению.
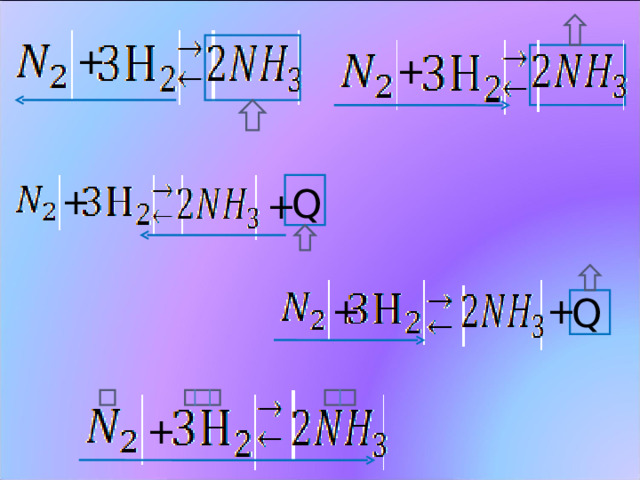
+
+
+
Q
+
+
Q
+
+

ДОМАШНЕЕ ЗАДАНИЕ:
Подумайте над вопросом:
«Какого человека можно считать уравновешенным?» Постарайтесь дать как можно больше определений этого понятия.