
Предельные углеводороды Электронное строение алканов

Определение
- Предельные углеводороды - это органические вещества, состоящие только из углерода и водорода, соответствующие общей формуле С n Н 2 n +2 .
- У этих веществ только простые одинарные связи между атомами углерода, которые соединяются с максимально возможным количеством числом атомов водорода. Их поэтому называют предельными или насыщенными.

Изомеры
- Изомеры - это вещества, имеющие одинаковый качественный и количественный состав, но отличающиеся по своему строению и свойствам
- Изомерия - это явление существования веществ с одинаковым качественным и количественным составом, но отличающимся по своему строению и свойствам

Примеры изомеров
- Для вещества с общей молекулярной формулой С 4 Н 10 существуют 2 изомера:
СН 3 -СН 2 -СН 2 -СН 3 (н - бутан, t кип.=-0,5 0 С)
СН 3 - СН -СН 3 (изобутан, t кип.=-11,7 0 С)
|
СН 3
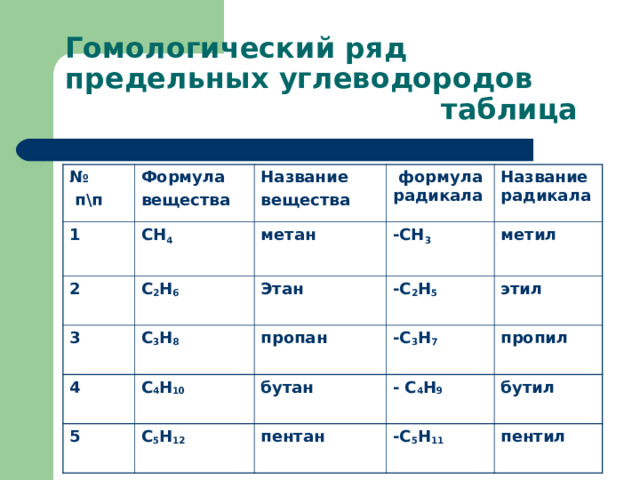
Гомологический ряд предельных углеводородов таблица
№
п\п
Формула
вещества
1
СН 4
2
Название
вещества
С 2 Н 6
формула радикала
метан
3
Название радикала
-СН 3
Этан
С 3 Н 8
4
С 4 Н 10
-С 2 Н 5
метил
пропан
5
С 5 Н 12
этил
бутан
-С 3 Н 7
- С 4 Н 9
пропил
пентан
бутил
-С 5 Н 11
пентил
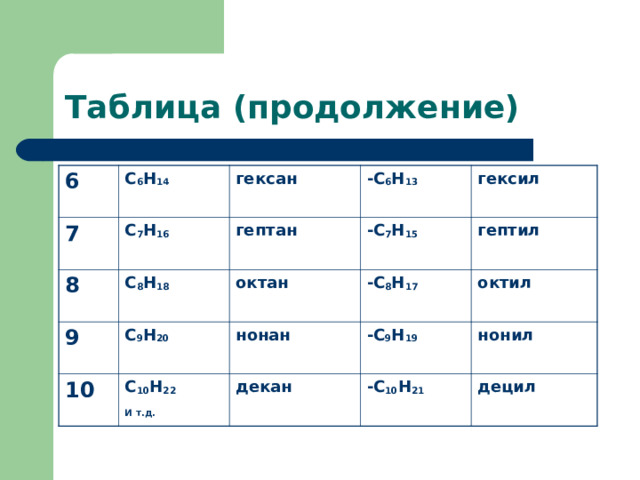
Таблица (продолжение)
6
С 6 Н 14
7
гексан
С 7 Н 16
8
-С 6 Н 13
С 8 Н 18
гептан
9
10
С 9 Н 20
октан
-С 7 Н 15
гексил
-С 8 Н 17
С 10 Н 22
И т.д.
гептил
нонан
октил
-С 9 Н 19
декан
-С 10 Н 21
нонил
децил

Гомологи
- Гомологи – вещества, расположенные в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН 2 -
- Гомологический ряд- ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН 2 -

Физические свойства предельных углеводородов
- Агрегатное состояние : первые четыре члена гомологического ряда(С 1 -С 4 ) – газы, С 5 -С 15 - жидкости, С 16 и более тяжелые – твердые вещества
- Температура кипения и плавления постепенно увеличиваются с ростом молекулярной массы вещества
- Растворимость в воде - плохая

Нахождение в природе и получение предельных углеводородов
Предельные углеводороды встречаются:
√ в природном газе (98%- метан);
√ в попутном нефтяном газе (С 1 -С 6 );;
√ в нефти (С 5 -С 50 );
√ в каменном угле
Получают их из природного сырья.

Химические свойства предельных углеводородов
Для предельных углеводородов характерны следующие химические реакции:
√ замещения (по свободно-радикальному механизму);
√ окисления (полное и неполное);
√ разложения (крекинг, дегидрирование);
√ изомеризации.
Для предельных углеводородов совсем не характерны реакции присоединения.

Реакции замещения
1. Реакция хлорирования на свету
1 2 3 4
СН 4 → СН 3 С l → СН 2 С l 2 → СН С l 3 → С С l 4
- СН 4 + Cl 2 → СН 3 С l ( первая стадия )
хлорметан
2. СН 3 С l + Cl 2 → СН 2 С l 2 ( вторая стадия )
дихлорметан
3. СН 2 С l 2 + Cl 2 → СН С l 3 ( третья стадия )
тр ихлорметан
4 . СН С l 3 + Cl 2 → С С l 4 ( четвертая стадия )
тетрахлорметан
2. Реакция нитрования(реакция Коновалрва)
СН 4 + Н NO 3 → СН 3 NO 2 +H 2 O
![Реакции окисления Полное окисление – горение СН 4 + 2О 2 →С О 2 +2Н 2 О + Q 2. Неполное окисление СН 4 + [ О ] →метиловый спирт, м метаналь (формальдегид), метановая (муравьиная)кислота](https://fsd.multiurok.ru/html/2024/01/24/s_65b0f1ce0d343/img11.jpg)
Реакции окисления
- Полное окисление – горение
СН 4 + 2О 2 →С О 2 +2Н 2 О + Q
2. Неполное окисление
СН 4 + [ О ] →метиловый спирт, м метаналь (формальдегид),
метановая (муравьиная)кислота

Реакции разложения
1 . крекинг (реакции идут при нагревании с разрывом углеродной цепи)
1500 0 С
СН 4 → 2С+2Н 2
С 4 Н 10 → С 2 Н 4 +С 2 Н 6
2. отщепление молекулы водорода (дегидрирование)
С 2 Н 6 → С 2 Н 4 +Н 2

Реакции изомеризации
В реакциях изомеризации не меняется количественный и качественный состав веществ, меняется лишь их пространственное строение
кат.
СН 3 -СН 2 -СН 2 -СН 3 , → СН 3 - СН -СН 3
!
СН 3
н - бутан изобутан

Применение предельных углеводородов
Предельные углеводороды находят свое применение как:
√ топливо (бензин, керосин, мазут и др.);
√ растворители ;
√ химическое сырье (для получения алкенов ацетилена, бутадиена и др.);
√ сырье для синтеза ( водорода, сажи, парафина, сероуглерода и др.)


















![Реакции окисления Полное окисление – горение СН 4 + 2О 2 →С О 2 +2Н 2 О + Q 2. Неполное окисление СН 4 + [ О ] →метиловый спирт, м метаналь (формальдегид), метановая (муравьиная)кислота](https://fsd.multiurok.ru/html/2024/01/24/s_65b0f1ce0d343/img11.jpg)






















