
Периоды
Ряды
Группы элементов
VII
VIII
VI
V
IV
II
I
III
Не
1
Н
1
2
1
s
4,003
1,008
Гелий
Водород
F
p
2
4
3
Be
2
Ne
В
5
8
6
9
О
N
7
С
3
Li
14.00 67
20.179
18.998
12,011
10,811
15,999
9.012
6,941
Углерод
Бериллий
Неон
Фтор
Кислород
Литий
Вор
Азот
d
Ar
3
1 6
3
Mg
S
Al
18
Na
13
11
12
1 4
P
15
Si
Cl
1 7
32,064
22,9898
24.305
26.981
39.948
35,453
30.974
28,086
Литий
Аргон
Сера
Алюминий
Натрий
Хлор
Фосфор
Кремний
28
27
26
Ni
Fe
Co
V
22
Ti
2 3
19
К
4
20
4
Ca
Mn
2 5
21
Sc
Cr
24
58.933
58.71
50,942
47.90
39,098
55,847
40.078
54,938
44,956
51,996
Титан
Ванадий
Железо
Кобальт
Никель
Калий
Кальций
Хром
Скандий
Марганец
3 2
Ge
2 9
Se
Cu
3 4
5
36
Kr
Zn
3 5
Br
30
31
As
Ga
3 3
72.61
63,546
78.96
83.80
69,72
79,904
65,37
74.922
Германий
Медб
Селен
Криптон
Галлий
Мышьяк
Бром
Цинк
45
44
Pd
46
Ru
Rh
Rb
37
Y
39
Te
43
5
6
Zr
40
Nb
41
38
42
Mo
Sr
102.91
106.4
101,07
85,47
83,906
97.906 4
91.22
92.906
87,62
95,94
Родий
Палладий
Рутений
Рубидий
Технеций
Иттрий
Молибден
Стронций
Цирконий
Ниобий
48
Sb
Cd
47
Ag
51
7
49
52
50
53
In
I
Sn
54
Xe
Te
121.75
107.87
112.41
114.82
116.71
126.90
131.30
127.60
Кадмий
Серебро
Сурьма
Теллур
Йод
Олово
Ксенон
Индий
78
Pt
77
76
Os
Ir
Re
Ba
56
W
Cs
55
Ta
6
8
* La
Hf
75
74
57
73
72
13 7.33
195,09
192,22
132,91
190,2
186.207
183.85
138.905
180.95
178.49
Барий
Осмий
Иридий
Платина
Цезий
Рений
Вольфрам
Лантан
Тантал
Гафний
82
Bi
Pb
Au
83
Hg
At
85
81
Tl
Po
84
9
86
Rn
80
79
209.99
207.2
208.98
204,37
208.99
(222)
200,59
196,99
Свинец
Висмут
Астат
Таллий
Понийт
Радон
Золото
Ртуть
109
108
Hs
Mt
Fr
87
Ra
88
Rf
Bh
7
*Ac
10
Db
Sg
89
104
107
105
106
223.02
266,14
226,03
265,132
262.12
262.11
261,11
227.03
263.12
Франций
Радий
Мейтнерий
Хассий
Дубний
Борий
Резерфордий
Актиний
Сиборгий
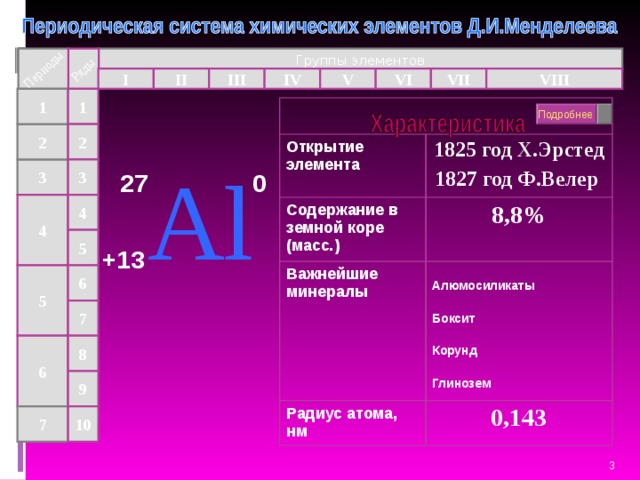
Периоды
Ряды
Группы элементов
VII
VIII
V
VI
III
IV
II
I
1
1
Открытие элемента
Содержание в земной коре (масс.)
1825 год Х.Эрстед
1827 год Ф.Велер
8,8%
Важнейшие минералы
Алюмосиликаты
Боксит
Корунд
Глинозем
Радиус атома, нм
0,143
Подробнее
2
2
А l
27
0
3
3
4
4
5
+13
6
5
7
8
6
9
10
7
2

1. Из истории открытия
2. Электронное строение
3. Строение простого вещества
4. Физические свойства
5. Свойства атома
6. Химические свойства
7. Нахождение в природе
8. Получение
9. Применение
3

1. Из истории открытия
главная
Впервые Al был получен датским физиком Эрстедом Х.
в 1825 г. Название элемента происходит от лат.
алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей (KAl(SO4)2 . 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
t
AlCl 3 +3K 3KCl + Al
Далее
3

1. Из истории открытия
Главная
В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.
Далее
Далее
5

2. Электронное строение
главная
А l
27
0
P + = 13
Порядок заполнения
e - = 13
+13
n 0 = 14
3e
2e
8e
3p 1
3p 1
3s 2
3s 2
2p 6
2p 6
2 s 2
2 s 2
1 s 2
1 s 2
Далее
Краткая электронная запись
5
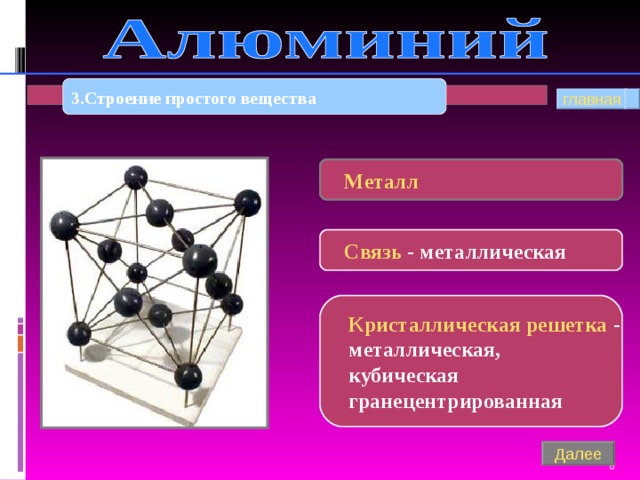
3 . Строение простого вещества
главная
Металл
Связь - металлическая
Кристаллическая решетка -
металлическая,
кубическая
гранецентрированная
Далее
7

4. Физические свойства
главная
Цвет – серебристо-белый
t пл. = 660 °C .
t кип. ≈ 2450 °C .
Электропроводный, теплопроводный
Легкий, плотность ρ = 2,6989 г/см 3
Мягкий, пластичный .
Далее
7
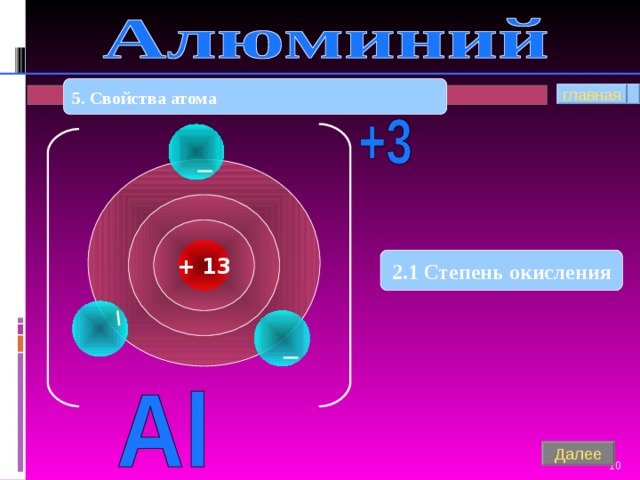
5. Свойства атома
главная
+ 13
2.1 Степень окисления
Далее
9

Периоды
5. Свойства атома
главная
Группы элементов
I
V
VIII
II
VI
VII
IV
III
1
B
2
Mg
Na
Al
3
2.2 Восстановительные
4
Ga
5
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al , Cr, Zn, Fe, Co, Pb,H 2 ,Cu,Hg,Ag
Ослабление восстановительных свойств
Далее
10
![6. Химические свойства главная C н е м е т а л л а м и (c кислородом, с серой) C неметаллами (c галогенами, с углеродом) C в о д о й C к и с л о т а м и C о щ е л о ч а м и C о к с и д а м и м е т а л л о в (Снять оксидную пленку) 2 Al + 6 H 2 O = 2Al(OH) 2 + H 2 ↑ 2 А l + 3Cl 2 = 2AlCl 3 4Al + 3C = Al 4 C 3 2 Al + 6 HCl = 2AlCl 3 + H 2 ↑ 2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + H 2 ↑ 2 Al + 6NaOH + 6H 2 O = 2Na 3 [ Al(OH) 6 ] + 3H 2 ↑ 2Al + 2NaOH + 2H 2 O =2NaAlO 2 +3H 2 ↑ 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe 2Al + WO 3 = Al 2 O 3 + W 4А l + 3O 2 = 2Al 2 O 3 t 2Al + 3S = Al 2 S 3 Далее 11](https://fsd.multiurok.ru/html/2019/01/19/s_5c435cb70399e/img11.jpg)
6. Химические свойства
главная
C н е м е т а л л а м и (c кислородом, с серой)
C неметаллами (c галогенами, с углеродом)
C в о д о й
C к и с л о т а м и
C о щ е л о ч а м и
C о к с и д а м и м е т а л л о в
(Снять оксидную пленку)
2 Al + 6 H 2 O = 2Al(OH) 2 + H 2 ↑
2 А l + 3Cl 2 = 2AlCl 3
4Al + 3C = Al 4 C 3
2 Al + 6 HCl = 2AlCl 3 + H 2 ↑
2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + H 2 ↑
2 Al + 6NaOH + 6H 2 O = 2Na 3 [ Al(OH) 6 ] + 3H 2 ↑
2Al + 2NaOH + 2H 2 O =2NaAlO 2 +3H 2 ↑
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
2Al + WO 3 = Al 2 O 3 + W
4А l + 3O 2 = 2Al 2 O 3
t
2Al + 3S = Al 2 S 3
Далее
11
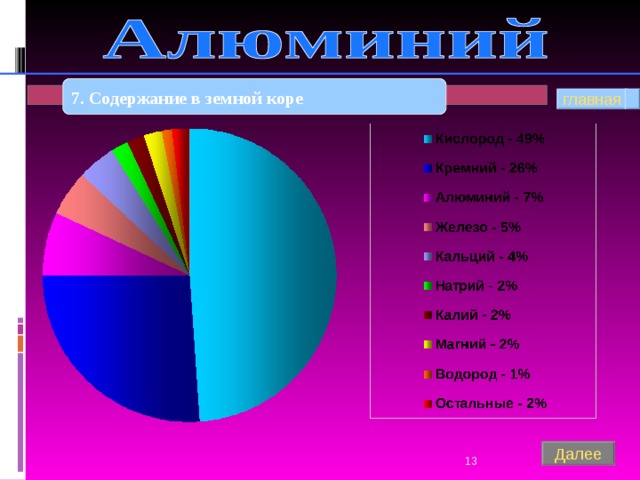
7. Содержание в земной коре
главная
11
Далее

7. Нахождение в природе
главная
Алюмосиликаты
Полевой шпат (ортоклаз) – K 2 O*Al 2 O 3 *6SiO 2
Нефелин - Na 2 O * Al 2 O 3 * 2SiO 2
Каолин – Al 2 O 3 * 2SiO 2 * 2H 2 O
Корунд – Al 2 O 3
Рубин (красный Cr +3 )
Сапфир (синий Ti +4 , Fe +2 , Fe +3 )
Бокситы – Al 2 O 3
Глинозем – Al 2 O 3
11
Далее

8. Получение
гл авная
1825 год Х. Эрстед: AlCl 3 + 3K = 3KCl + Al :
Электролиз ( t пл. = 2050 ° С) : 2Al 2 O 3 = 4 Al + 3O 2
Электролиз ( в распл. криолите Na 3 AlF 6 , t пл. ≈ 1000 ° С ) :
2Al 2 O 3 = 4 Al + 3O 2
Далее
14
главная
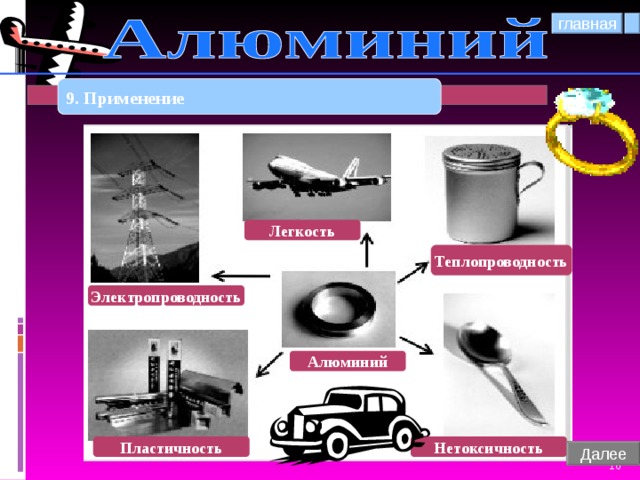
9. Применение
Легкость
Теплопроводность
Электропроводность
Алюминий
Пластичность
Нетоксичность
Далее
15















![6. Химические свойства главная C н е м е т а л л а м и (c кислородом, с серой) C неметаллами (c галогенами, с углеродом) C в о д о й C к и с л о т а м и C о щ е л о ч а м и C о к с и д а м и м е т а л л о в (Снять оксидную пленку) 2 Al + 6 H 2 O = 2Al(OH) 2 + H 2 ↑ 2 А l + 3Cl 2 = 2AlCl 3 4Al + 3C = Al 4 C 3 2 Al + 6 HCl = 2AlCl 3 + H 2 ↑ 2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + H 2 ↑ 2 Al + 6NaOH + 6H 2 O = 2Na 3 [ Al(OH) 6 ] + 3H 2 ↑ 2Al + 2NaOH + 2H 2 O =2NaAlO 2 +3H 2 ↑ 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe 2Al + WO 3 = Al 2 O 3 + W 4А l + 3O 2 = 2Al 2 O 3 t 2Al + 3S = Al 2 S 3 Далее 11](https://fsd.multiurok.ru/html/2019/01/19/s_5c435cb70399e/img11.jpg)






















