1. Массовая доля растворенного вещества
1.1 Приготовление растворов с заданной концентрацией
| Последовательность действий | Выполнение действий |
| 1. Записать формулу массовой доли растворенного вещества и вывести из нее формулу массы растворенного вещества | 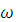 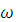 (р. в.) = т (p. b.)/ т (р-ра) = (р. в.) = т (p. b.)/ т (р-ра) = т (р. в.) = 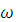 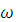 (р. в.) • т (р-ра) (р. в.) • т (р-ра) |
| 2. Вычислить массу растворенного вещества |
|
| 3. Вычислить массу воды (ее объем) | 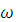 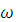 (H20) = т (р-ра) - т (p. b.) (H20) = т (р-ра) - т (p. b.)
|
| 4. Записать ответ | Чтобы приготовить __ г __%-го раствора соли, надо взвесить __ г соли, отмерить __ мл воды и растворить соль в воде |
1.2 Разбавление растворов
| Последовательность действий | Выполнение действий |
| 1. Найти массу растворенного вещества в исходном растворе | т (р. в.) = 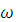 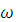 1 (р. в.) • т1 (р-ра) 1 (р. в.) • т1 (р-ра) |
| 2. Найти массу полученного раствора | тг (р-ра) = т1 (р-ра) + m(H20), |
| 3. Найти массовую долю соли в полученном растворе
| 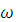 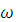 2 (р. в.) = т (p. b.)/ тг (р-ра) 2 (р. в.) = т (p. b.)/ тг (р-ра)
В общем виде выражение для 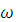 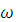 2 (р. в.) имеет вид 2 (р. в.) имеет вид 
|
1.3 Концентрирование растворов
| Последовательность действий | Выполнение действий |
| 1. Найти массу растворенного вещества в исходном растворе | т1 (р. в.) = 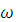 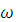 1 (р. в.) • т1 (р-ра) 1 (р. в.) • т1 (р-ра) |
| 2. Найти массу растворенного вещества в полученном растворе | т2 (р. в.) = т1 (р. в.) + тв-ва |
| 3. Найти массу полученного раствора | т2 (р-ра) = т1 (р-ра) + тв-ва |
| 4. Найти массовую долю вещества в полученном растворе | 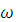 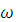 2 (р. в.) = т2 (p. b.)/ тг (р-ра) 2 (р. в.) = т2 (p. b.)/ тг (р-ра)
|
| 5. Записать ответ |
|
1.4 Смешивание двух растворов
| Последовательность действий | Выполнение действий |
| 1. Записать формулу массовой доли растворенного вещества | 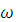 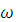 3 = т3 (p. в.)/ т3 (р-ра) 3 = т3 (p. в.)/ т3 (р-ра)
|
| 2. Записать значения т3 (р. в.) и т3(р-ра) | т3 (р.в) = т1 (р.в.) + т2 (р.в.) т3 (р-ра) = т1 (р-ра) + т2 (р.в.) |
| 3. Произвести вычисления |
|
2. Вычисления по уравнениям реакций
Записать в «ДАНО» массы или количество вещества по условию задачи, с указанием формулы вещества (например: m(H2 SO4) = 56г).
Составить уравнение химической реакции.
В уравнении одной чертой подчеркнуть формулы веществ, массы которых указаны в условии задачи, а двумя чертами – формулы тех веществ, массы которых требуется вычислить.
Под формулами этих веществ указать количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед веществами в уравнении реакции).
Массу вещества, данную в условии задачи, перевести в моль:
и поставить над формулой вещества.
Над неизвестным веществом поставить х моль.
По уравнению реакции установить соотношение количеств веществ и найти искомую величину.
Записать ответ.
Вычисления по химическим уравнениям с использованием физической величины «молярный объём газа».
Записать в «ДАНО» объём газа или количество вещества по условию задачи, с указанием формулы вещества (например: V(H2 ) = 2л).
Составить уравнение химической реакции.
В уравнении одной чертой подчеркнуть формулы газов , объёмы которых указаны в условии задачи, а двумя чертами – формулы тех газов, объёмы которых требуется вычислить.
Под формулами этих веществ указать количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед веществами в уравнении реакции).
Объём вещества, данный в условии задачи, перевести в моль:
и поставить над формулой вещества (вместо молярной массы в расчетах используют молярный объём Vm=22,4 л/моль).
Над неизвестным веществом поставить х моль.
По уравнению реакции установить соотношение количеств веществ и найти искомую величину.
Записать ответ.
Вычисления по уравнениям реакций, если одно из веществ дано в избытке.
Записать в «ДАНО» массы, объёмы (для газов) или количество вещества по условию задачи, с указанием формулы вещества (например: m(H2 SO4) = 56г, V(H2 ) = 2л).
Составить уравнение химической реакции.
Определить вещество, данное в избытке:
Способ 1.
Вычислить число молей реагирующих веществ.
Установить мольное соотношение реагирующих веществ, исходя из данных задачи, и сравнить его с мольным отношением, вытекающим из уравнения реакции.
Способ 2.
Вычислить число молей реагирующих веществ.
Число молей взаимодействующих веществ по условию задачи (ν1 (по усл.)) и (ν2 (по усл.)) разделить на количество соответствующих веществ по уравнению реакции (ν1 (по уравн.)) и (ν2 (по уравн.)), т.е.
(ν1 (по усл.)) и (ν2 (по усл.))__
(ν1 (по уравн.)) (ν2 (по уравн.))
То число, которое больше, указывает на вещество, взятое в избытке.
Вычисления продукта реакции проводим по веществу, которое полностью вступает в реакцию, т.е. взятому в недостатке.
5. Составление уравнений реакции диссоциации
В левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости, что определяется силой электролита;
В правой части уравнения записать количество образующихся положительно и отрицательно заряженных ионов (числа ставятся перед ионами);
Указать величину и знак заряда ионов;
Проверить сумму положительных и отрицательных зарядов (она должна быть равна нулю).
6. Реакции ионного обмена
Простые вещества, газы, оксиды, нерастворимые соединения не диссоциируют (в ионных уравнениях их записывают в молекулярном виде).
Малорастворимые вещества в левой части уравнения записывают в виде ионов, а в правой части — в молекулярном виде (т. е. считают нерастворимыми).
Общая сумма зарядов ионов в левой части уравнения должна быть равна общей сумме зарядов ионов в правой части. Реакции ионного обмена идут до конца, если образуется: а) осадок; б) газ; в) малодиссоциирующее вещество
Составление ионных уравнений реакций.
1. Записать молекулярное уравнение реакции, подобрать коэффициенты
2. Найти среди продуктов реакции вещество, образование которого вызывает протекание реакции. Это может быть 1) осадок, 2) газ, 3) слабый электролит.
3. С помощью таблицы растворимости определить растворимость каждого вещества
4. Составить полное ионное уравнение реакции, записав электролиты в виде ионов, неэлектролиты — в молекулярном виде.
5. Исключить из обеих частей ионно–молекулярного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции.
6. Выписать оставшиеся ионы и в результате получить сокращенное ионно-молекулярное уравнение, которое и выражает сущность данной реакции.
Вычисление абсолютной массы атомов (в а.е.м., граммах и килограммах) на основе Периодической системы химических элементов
Определить относительную атомную массу (Ar) с помощью Периодической системы химических элементов.
Определить массу атома в а.е.м. по формуле:
ma(X) = Ar(X) • 1 а.е.м.
Определить массу атома в граммах по формуле:
ma(X) = Ar(X) • 1 а.е.м. = Ar(X) • 1,66-24г
Определить массу атома в килограммах по формуле:
ma(X) = Ar(X) • 1 а.е.м. = Ar(X) • 1,66-27кг
8. Вычисление относительной молекулярной массы веществ
В Периодической системе химических элементов найти символы химических элементов, входящих в составолекулы вещества и выписать округлённые значения относительных атомных масс (Ar) .
Умножить эти значения на число атомов (т.е. на индекс) каждого элемента в молекуле.
Сложить относительные атомные массы всех элементов.
9. Вычисление массовой доли химического элемента в веществе по его формуле
Найти относительную молекулярную массу данного вещества (Mr).
Рассчитать массовую долю элемента по формуле:
ω(Х)% = Ar(Х) • n • 100%
Mr ,
где ω(Х)% - массовая доля элемента в процентах,
Ar(Х) - относительная атомная масса элемента,
N - число атомов (индекс) элемента Х в молекуле вещества,
Mr - относительная молекулярная масса вещества
10. Определение относительной плотности газов
Относительная плотность одного газа по другому – безразмерная величина, равная отношению их молярных (М) или относительных молекулярных (Mr) масс:
D= M1/M2 или D = Mr1/Mr2
То есть, для решения таких задач, необходимо находить молярные (М) или относительные молекулярные (Mr) массы газов.
11. Вычисление массы или объёма продукта реакции по известной массе или объёму исходного вещества, содержащего определённую массовую долю примесей.
Чтобы определить массу или объём получаемого продукта, необходимо вначале рассчитать массу или объём чистого вещества, которое содержится в исходной смеси, а потом решать задачу по химическому уравнению. Содержание примеси обычно выражают в процентах. Массу чистого вещества (как и объём) можно вычислить двумя способами.
Способ 1.
Массу чистого вещества (как и объём0 определяют следующим образом:
ω(чист. в-ва)=100% - ω(примеси);

ω(чист. в-ва)= m(чист. в-ва)/m(смеси)

m(чист. в-ва)= m(смеси) • ω(чист. в-ва)
Способ 2.
Вначале определяют массу примеси:
m(примеси)= m(смеси) • ω(примеси),
а затем вычитают её из массы смеси:
m(чист. в-ва)= m(смеси) - m(примеси)
























