Урок № 51
.Тема:Электролитическая диссоциация.
Степень электролитической диссоциации. .Сильные и слабые электролиты.
.Реакции ионного обмена. .
Цель: сформировать понятия об электролитах и неэлектролитах ; дать понятие о сущности реакций ионного обмена ; познакомить обучающихся с реакциями ионного обмена и условиями их протекания; научиться составлять ионные уравнения; закрепить знания пользоваться таблицей растворимости для прогнозирования возможных химических реакций; совершенствование химического языка обучающихся.
Задачи:
совершенствовать навыки составления полных и сокращенных ионных уравнений реакций.
продолжать формировать умение анализировать полученную информацию, применять при высказывании суждений ранее полученные знания,
совершенствовать навыки решения практических задач;
воспитывать у обучающихся организованность, самостоятельность, способствовать развитию безопасного и аккуратного выполнения химических опытов и бережного отношения к окружающей среде.
Оборудование: экран, табл. растворимости.
Ход урока:
Организационный этап :Проверка отсутствующих, проверка готовности к уроку.
Актуализация знаний
1. Массовая доля (весовые проценты, процентная концентрация)
2 Молярность (молярная концентрация)
3. Растворимость вещества
4. Классификация растворов
Решить задачу: Рассчитайте массу воды и массу соли, которые необходимо взять для приготовления 130 г раствора хлорида натрия NaCl с концентрацией 6%.
3. Мотивация учебной деятельности
Обратимся к истории 1837 года. В этот период в Лондоне в лаборатории Королевского института работали два учёных: Гемфри Деви и Майкл Фарадей. Они начали исследования в области электричества и ввели понятия, которыми мы пользуемся до сих пор. Деви и Фарадей проводили опыты по определению электропроводности растворов, используя специальный прибор. Он состоял из 2-х электродов, лампочки и розетки. При опускании электродов в исследуемое вещество, если оно проводит ток, то лампочка загорается, если не проводит – не загорается. Ученые назвали вещества, которые проводят электрический ток электролитами, а те, что не проводят ток - неэлектролитами
4. Изучение нового материала.
План
1. Электролиты и неэлектролиты.
2.Электролитическая диссоциация.
3. Основания, кислоты, соли в свете теории электролитической диссоциации:
4. Степень диссоциации. Сильные и слабые электролиты
5. Реакции ионного обмена.
1. Электролиты и неэлектролиты.
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток. К ним относятся вода, кислоты, основания и соли. При растворении в воде молекулы электролитов диссоциируют на положительные ионы – катионы и отрицательные – анионы.
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток.
2.Электролитическая диссоциация
Распад молекул электролита на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
Процесс электролитической диссоциации обусловлен взаимодействием веществ с водой или другим растворителем, что приводит к образованию гидратированных ионов.
Так, ион водорода образует ион гидроксония:
Н+ + Н2О =Н3О+.
Впервые теорию электролитической диссоциации (разделения) сформулировал в 1887 г. шведский ученый С. Аррениус, ее основные положения заключались в следующем:
Основные положения теории электролитической диссоциации:
электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы - к аноду (положительному электроду);
электролитическая диссоциация является обратимым процессом - параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.
Через несколько лет, в 1891 г., русский ученый И. Каблуков внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом).
3. Основания, кислоты, соли в свете теории электролитической диссоциации:
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например,
HNO3 = H+ + NO3–
Многоосновные кислоты диссоциируют ступенчато. Например сероводородная кислота диссоциирует ступенчато:
H2S = H+ + HS– (первая ступень)
HS =H+ + S2– (вторая ступень)
Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например,
NaOH : Na+ + OH–
Многокислотные основания диссоциируют ступенчато
Mg(OH)2 « MgOH+ + OH– (первая ступень)
MgOH+ « Mg2+ + OH– (вторая ступень)
Солями называют электролиты, которые при диссоциации образуют катионы металлов, или комплексные катионы, и анионы кислотных остатков, или комплексные анионы.
Средние соли, растворимые в воде, диссоциируют практически полностью
Al2(SO4)3 = 2Al3+ + 2SO42–
(NH4)2CO3 = 2NH4+ + CO32–
4. Количественной характеристикой электролитической диссоциации является степень диссоциации a, равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N)
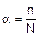
Степень диссоциации выражается в долях единицы или процентах.
По степени диссоциации все электролиты делятся на сильные (a30%), слабые (a
Сильные электролиты при растворении в воде полностью диссоциируют на ионы.
Слабые электролиты частично диссоциируют на ионы при растворении в воде.
| Сильные | Средние | Слабые |
| Кислоты: НСl, HBr, HJ, HNO3, H2SO4, HClO3, HClO4, HBrO3, HJO3, HMnO4 Щелочи: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Все растворимые соли. | Кислородсодержащие кислоты P, S, Cl (HPO3, H3PO4, H4P2O7, H2SO3, HClO2), H3AsO4, Mg(OH)2 HF, Fe(OH)2 | H2S, HCN, H2CO3, HClO, HClO2, H3BO3, H2SiO3, HNO2, HF, H3PO3, NH4OH, H2O. Нерастворимые основания (Cu(OH)2, Fe(OH)3 Al(OH)3 Cr(OH)3 , органические кислоты (HCOOH, CH3COOH, C2H5COOH) |
5. Реакции ионного обмена – это реакции, протекающие между ионами в растворе или расплаве. Реакции ионного обмена в водных растворах могут протекать обратимо и необратимо. Необратимо, или до конца, они протекают в том случае, если в результате образуются нерастворимые, газообразные или мало диссоциируемые вещества.
Для реакций ионного обмена составляют молекулярные, полные ионные и сокращенные ионные уравнения.
Правила:
1. Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли не диссоциируют.
2. Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Во всех остальных случаях реакции ионного обратимы и значит в них устанавливается химическое равновесие. Для таких реакций мы не пишем уравнения в ионном виде
1: Реакции, идущие с образованием нерастворимого вещества.
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH- → Cu(OH)2 + 2Na+ + SO42-
Cu2+ +2OH- → Cu(OH)2↓
2: Реакции, идущие с образованием газа.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + Cl- + H2O + CO2
CO 32- + 2H+ = H2O + CO 2↑
3: Реакции, идущие с образованием малодиссоциирующего вещества.
Взаимодействие гидроксида натрия с соляной кислотой.
NaOH + HCl = NaCl + H2O
Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O
OH– + H+ = H2O
5. Закрепление полученных знаний
№ 1. Выбрать из данного перечня веществ электролиты и неэлектролиты:
KCl, CuO, CuSO4, Cu(OH)2, BaSO4, K2SO4.
Для электролитов написать уравнения диссоциации
№ 2. записать реакциив молекулярном, полном, кратком ионном виде:
KOH + NH4Cl = KCl + NH4OH
Na2O + 2H3PO4 (р) = 2Na3PO4 (р) + 3H2O
№ 3. Дана схема: 2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения
6. Домашнее задание
Читать конспект. Выполнить задания: Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 -
K2S + H3PO4 -
























