ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ И ЕЁ ОСНОВНЫЕ ПОЛОЖЕНИЯ
8 класс


кристаллические решетки
В узлах кристаллической решетки солей находятся ионы металла и ионы кислотного остатка. Это соединения с ионной связью.

кристаллические решетки
У оснований в узлах кристаллической решетки находятся ионы металла и ионы гидроксогруппы.
NaOH

органические вещества
Если в состав соединения входят атомы углерода, водорода и кислорода, то связи между атомами ковалентные. Молекулы таких соединений нейтральны, в их структуре нет ионов. Поэтому органические вещества являются неэлектролитами.

диссоциация

автор ТЭД
В 1903 году шведскому ученому
Аррениусу, автору ТЭД, была присуждена Нобелевская премия как
факт признания особого значения ТЭД для развития химии.
1883-1884 гг. он изучал электропроводность сильно разбавленных растворов электролитов, задавая себе вопросы: что происходит с молекулой электролита в растворе? Свои наблюдения изложил в докторской диссертации.

ТЭД
Русские ученые И.А. Каблуков и В.А. Кистяковский , применяя
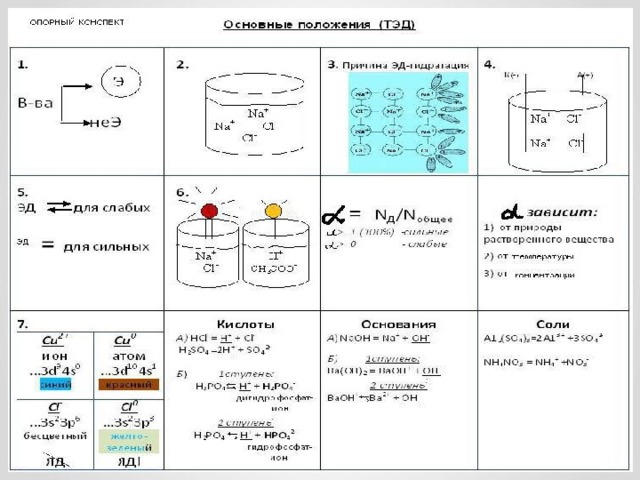
химическую теорию растворов Д.И. Менделеева, доказали, что при растворении электролита идет химическое взаимодействие вещества с водой, происходят образование гидратов и их диссоциация на ионы. В растворе находятся ионы, окруженные молекулами воды, - это гидратированные ионы.
Иван Алексеевич Каблуков
Владимир Александрович Кистяковский
Иван Алексеевич Каблуков

Задание
Из предложенных веществ выберите электролиты:
углекислый газ, нитрат кальция, сульфат алюминия, бензин, глюкоза, разбавленная серная кислота, гидроксид натрия, гидроксид меди (II), хлорид бария, поваренная соль, оксид кальция, бромид магния.
Проверь себя: число электролитов равно числу электронов на внешнем энергетическом уровне атома хлора.
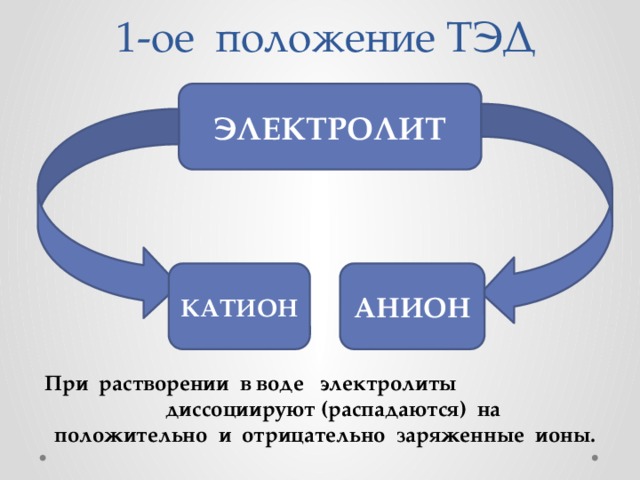
1-ое положение ТЭД
ЭЛЕКТРОЛИТ
КАТИОН
АНИОН
При растворении в воде электролиты диссоциируют (распадаются) на
положительно и отрицательно заряженные ионы.


2-ое положение ТЭД
Причиной диссоциации электролита в водном растворе является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи. При гидратации ионов энергия выделяется, а на разрушение кристаллической решетки и переход гидратированных
ионов в раствор – затрачивается.
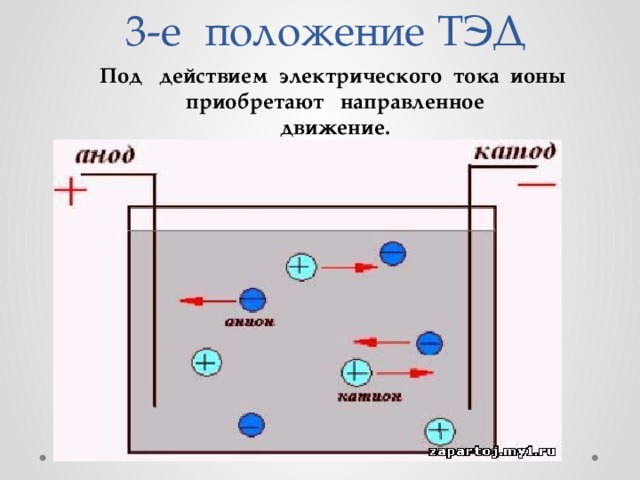
3-е положение ТЭД
Под действием электрического тока ионы приобретают направленное
движение.

4-е положение ТЭД
Электролитическая диссоциация - процесс обратимый для слабых электролитов. Наряду с процессом распада электролита на ионы идет процесс соединения ионов в молекулы электролита – ассоциация.
В уравнениях диссоциации ставится знак обратимости (↔), особенно это касается слабых электролитов. Они диссоциируют ступенчато.
Н 3 РО 4 ↔ Н + + Н 2 РО - 4 (первая ступень) – дигидроортофосфат ион
Н 2 РО - 4 ↔ Н + + НРO 2- 4 (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион

5-е положение ТЭД
Не все электролиты в одинаковой мере диссоциируют на ионы.

6-е положение ТЭД
Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
По характеру образующихся при диссоциации электролитов ионов различают три типа электролитов:



3