Просмотр содержимого документа
«Закон сохранения массы веществ. Химические уравнения.»

Закон сохранения массы веществ. Химические уравнения
Омельянчук Т.Е.
учитель химии МОУ ДСОШ №2
г. Домодедово

Цель урока:
Изучение закона сохранения массы веществ. Формирование понятия о химическом уравнении. Научить расставлять коэффициенты в уравнениях реакций.

М.В.Ломоносов в 1748 г. впервые
сформулировал, а в 1756 г.
экспериментально доказал закон
сохранения массы веществ
А.Лавуазье в 1789 г
независимо от
Ломоносова к пришел
тем же выводам


Формулировка закона
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
Сосуд Ландольта
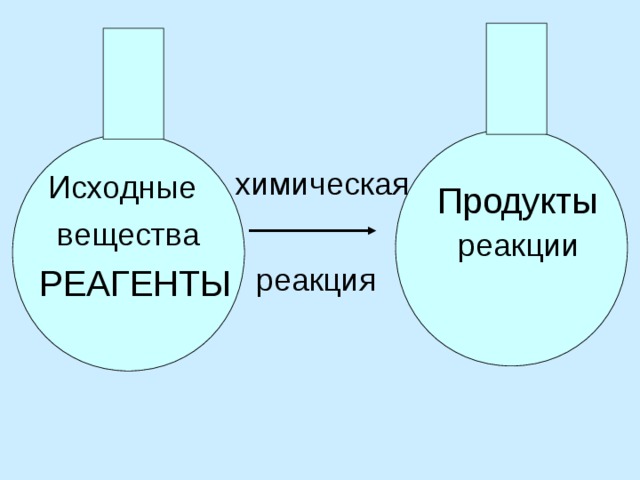
химическая
Исходные
вещества
РЕАГЕНТЫ
Продукты
реакции
реакция

Атомы не появляются и не исчезают при химической реакции
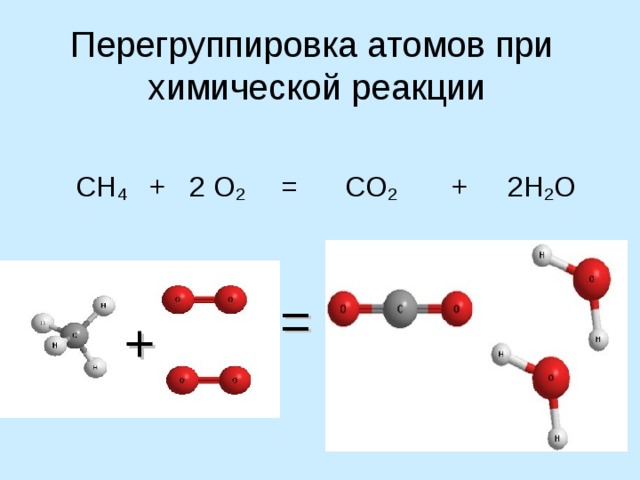
Перегруппировка атомов при химической реакции
СН 4 + 2 О 2 = СО 2 + 2Н 2 О
=
+
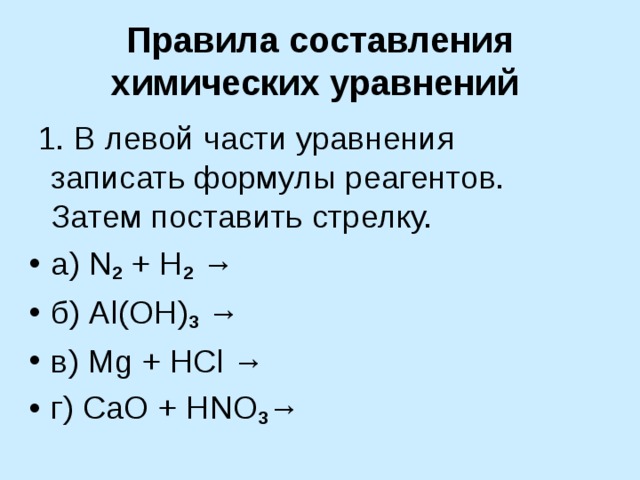
Правила составления химических уравнений
1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку.
- а) N 2 + H 2 →
- б) Al ( OH ) 3 →
- в) Mg + HCl →
- г) С aO + HNO 3 →
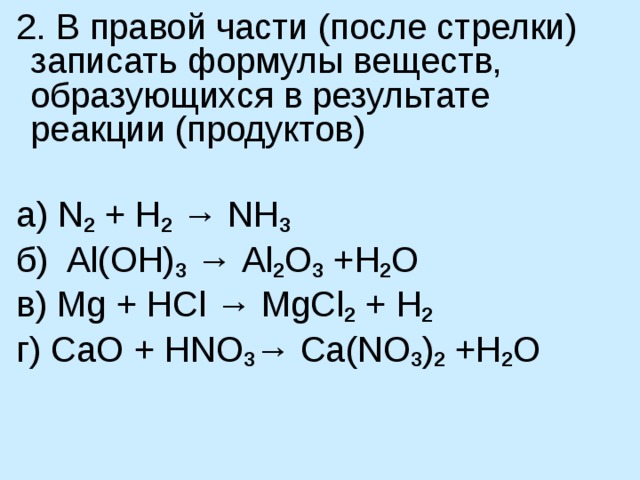
2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов)
а) N 2 + H 2 → NH 3
б) Al ( OH ) 3 → Al 2 O 3 + H 2 O
в) Mg + HCl → MgCl 2 + H 2
г ) С aO + HNO 3 → Ca(NO 3 ) 2 + H 2 O

3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно быть равное число атомов. Это достигается расстановкой коэффициентов перед формулами веществ.

Алгоритм расстановки коэффициентов в уравнении химической реакции.
1. Подсчитать количество атомов каждого элемента в правой и левой части .
2. Определить, у какого элемента количество атомов меняется, найти Н.О.К.
3. Разделить Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед формулами.

4. Пересчитать количество атомов, при необходимости действия повторить.
5. Начинать лучше с атомов О или любого другого неметалла (если только О не находится в составе нескольких веществ).
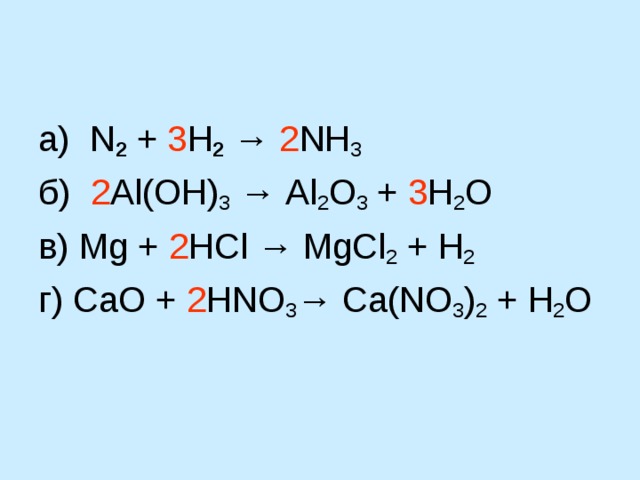
а) N 2 + 3 H 2 → 2 NH 3
б) 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O
в) Mg + 2 HCl → MgCl 2 + H 2
г) С aO + 2 HNO 3 → Ca ( NO 3 ) 2 + H 2 O

Выводы:
- Новые вещества не получаются из ничего и не могут обратиться в ничто.
- При химических реакциях происходит перегруппировка атомов
- Масса веществ, вступивших в реакцию равна массе образовавшихся веществ
- При составлении уравнений нужно соблюдать закон сохранения массы веществ

Список источников:
- http://historydoc.edu.ru/catalog.asp?cat 04.10.2010
- ob_no=&ob_no=14805 /04.10.2010
- http://www.erudition.ru/referat/ref/id/4051_1.html/ 04.10.2010
- http://www.hemi.nsu.ru/text152.htm 04.10.2010
- http://wiki.saripkro.ru/index.php/% 04.10.2010
- http://yacovleva-28.ucoz.ru/publ/3-1-0-1/04.10.2010










































