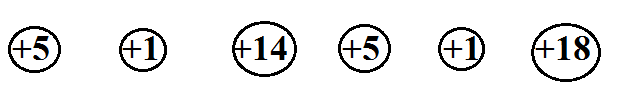КОМИТЕТ ПО ОБРАЗОВАНИЮ ГОРОДА ПОДОЛЬСКА
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа № 14»
г. о. Подольска Московской области
Урок
Строение атома. Изотопы
Учитель: Купцова Анна Викторовна
Подольск
2018
Тема: Строение атома. Изотопы.
Цели: рассмотреть о строении атомов, сформировать понятия «протон», «нейтрон», «электрон», «изотопы», способствовать формированию умений определять количество электронов, протонов, нейтронов используя Периодическую систему; уточнить определение понятия «химический элемент»; развивать интерес к предмету, развивать умение логически рассуждать, грамотно выражать свои мысли; развивать умение работать коллективно, оценивать ответы своих товарищей».
Форма деятельности на уроке: индивидуальная работа учащихся, организация самостоятельной работы школьников в малой группе, работа в парах, фронтальная работа учителя с классом.
Средства обучения: раздаточный материал, учебник.
Ход урока
1. Организационный момент
Учитель приветствует учащихся, определяет готовность к уроку и создаёт благоприятный микроклимат в классе.
2. Целеполагание и мотивация
1. Учитель задаёт классу проблемный вопрос: «Почему в парах элементов аргон-калий, кобальт – никель, теллур-йод впереди стоящий элемент имеет большую массу, чем последующий? Почему атомные массы обозначаются дробными числами? Предложите свои версии ответов».
Учащиеся отвечают.
2. Постановка проблемы.
- Ребята, задание было одно?
- А какие получились результаты?
- Как вы думаете почему?
У вас не хватает знаний, чтобы ответить на эти вопросы.
Ответ на этот вопрос мы узнаем в ходе урока.
Учитель предлагает учащимся индивидуально в своих тетрадях записать дату и тему урока.
4. Постановка цели.
- Предположите в группах, что мы должны узнать на сегодняшнем уроке?
Учитель выслушивает мнение каждой группы. Уточняет, что ещё будем учиться определять количественный состав атома.
3. Планирование деятельности
Учитель предлагает учащимся наметить план достижения поставленной цели.
Повторим, какую информацию об атоме мы можем узнать по Периодической таблице;
узнаем состав атомов, понятие «изотопы»;
узнаем, как определять количество частиц в атомах;
выполним упражнения.
4. Изучение нового материала, первичное закрепление
1. Учитель предлагает учащимся выполнить частично-поисковое задание.
1. Представьте и опишите ситуацию: а) все атомы положительно заряжены; б) все атомы отрицательно заряжены; в) одни атомы заряжены отрицательно, а другие - положительно.
Учащиеся высказывают предположения. Учитель, подводя итог, формулирует вывод: атом – нейтральная частица.
2. Учитель предлагает поработать с учебником и ответить на вопрос: «В чём значение работ Д.Томсона, Э.Резерфорда и др. в исследовании структуры атомов?»
3. Учитель предлагает учащимся, используя рисунок «Строение атома»,
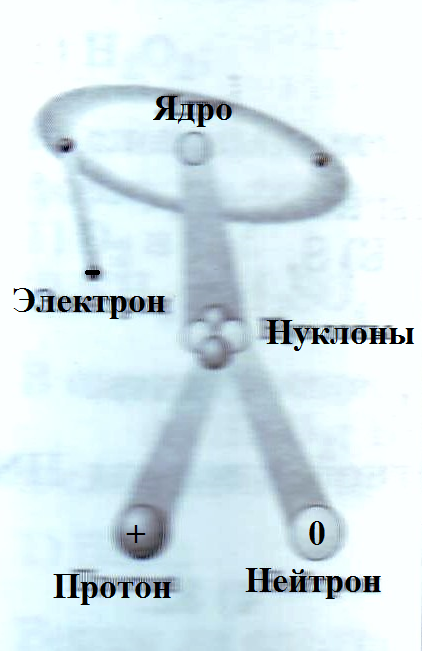
и таблицу из учебника заполнить пропуски в тексте:
Протоны. Обозначают , имеют массу и заряд .
Нейтроны. Обозначают , имеют массу и заряд .
Нуклоны – это _____________________________________.
Электроны. Обозначают , имеют массу и заряд .
Учащиеся индивидуально выполняют задание.
Затем учитель организует краткое обсуждение текста по вопросам:
Из каких частиц состоит атом?
В какой части атомного пространства располагаются электроны?
Что вы знаете об электроне?
Какими частицами образовано ядро атома?
Почему ядро имеет положительный заряд?
В какой части атома сосредоточена практически вся его масса?
Что вы знаете о протоне?
Что вы знаете о нейтроне?
Учащиеся участвуют в обсуждении вопросов.
4. Учитель предлагает учащимся выполнить частично-поисковое задание.
Имеется две пары слов. Между словами первой пары существует определённая связь. Такая же смысловая связь объединяет и вторую пару слов. Известно только первое слово 2-й пары. Подберите для него второе слово из тех, которые записаны в скобках:
а) Солнечная система Солнце
атом (нуклоны, электроны, ядро);
б) электрон отрицательно заряженная частица;
протон (ядро атома водорода, положительно заряженная частица, электронейтральная частица).
Учащиеся обсуждают результаты выполнения задания.
5. Учитель рассказывает учащимся о правилах определения числа элементарных частиц в атомах, отмечая гениальность Д. И. Менделеева, который, не зная о строении атомов, создал периодическую систему, позволяющую давать точную количественную характеристику состава атомов.
Число протонов р+ = порядковому номеру элемента.
Число электронов е - = числу протонов = порядковому номеру элемента.
Число нейтронов n0 = атомная масса Аr – порядковый номер (число протонов).
Учащиеся записывают правила.
6. После этой информации по вариантам выполняют задание. Двое учащихся выполняют его на обратной стороне доски.
Определите число протонов, электронов, нейтронов в атомах элементов:
Вариант 1: кислород, кальций.
Вариант 2: азот, магний.
Проверяют фронтально результат выполнения работы. Учитель при наличии ошибок организует коррекцию, используя опыт учащихся.
7. Учитель предлагает учащимся выполнить проблемно-поисковое задание.
Сколько химических элементов изображено на рисунке, показывающем заряды ядер их атомов?
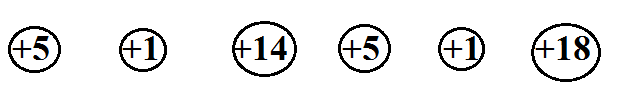
Обсуждают выполнение задания и формулируют уточнённое определение понятия «химический элемент».
Химический элемент – это вид атомов с одинаковым зарядом ядра.
8. Учитель предлагает учащимся выполнить задание.
Проанализируйте рисунок, изображающий состав ядер трёх различных атомов. Впишите в текст пропущенные слова.
|
| 
| 
| 
|
| Число протонов | | | |
| Заряд ядра атома | | | |
| Это атомы химического элемента | |
| Число нейтронов | | | |
| Массовое число | | | |
| Это изотопы водорода: | 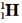
| 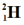
| 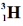
|
В результате обсуждения выполнения задания формулируют определение понятия «изотопы».
9. Учитель предлагает учащимся ознакомиться с расчетом относительной атомной массы хлора:
и сделать вывод о том, как рассчитывают относительную атомную массу.
10. Учитель предлагает учащимся вернуться к вопросам, с которых начался урок и попробовать ответить на них. Подводит итог обсуждения.
5. Рефлексия Учитель организует рефлексию:
- Достигнута ли цель урока?
- Мы осуществили все этапы намеченного плана работы?
- Если вам была понятна тема урока, и вы продвинулись в своих знаниях,
то возьмите веселого смайлика, а если остались моменты непонимания, то грустного или серьезного.
Учащиеся подходят к столу учителя и «голосуют» с помощью смайликов.
6. Домашнее задание - Запишите домашнее задание в дневник
§ 6. Найдите в дополнительной литературе (или иных источниках) информацию об изотопах одного из элементов и рассчитайте относительную атомную массу с учетом содержания их в земной коре (задание по желанию).