Тема: Магний и щелочноземельные металлы. Жесткость воды и способы ее устранения
Цель: Дать общую характеристику металлов главной подгруппы II группы.
Задачи: Образовательные: дать общую характеристику металлов главной подгруппы II группы; рассмотреть основные физические и химические свойства этих элементов.
Развивающие: продолжить формирование устойчивого интереса к химической науке и практике, положительных мотивов учения, развивать логическое мышление и интеллектуальные умения (анализировать, сравнивать, устанавливать причинно-следственные связи, делать выводы), внимательность, самостоятельность при выполнении заданий; совершенствовать умения составления уравнений химических реакций.
Воспитательные: воспитывать интерес к химии как науке, сознательное отношение к химическим знаниям
Теоретический материал
https://interneturok.ru/lesson/chemistry/9-klass/himiya-metallov/elementy-podgruppy-a-ii-gruppy
Во 2 группу входят следующие элементы бериллий, магний, кальций, стронций, барий радий. Последние четыре элемента получили название щелочноземельных. Такое название обусловлено тем, что эти элементы встречаются в природе в составе минералов-карбонатов, прокаливание которых и дальнейшее растворение полученных продуктов приводит к образованию щелочного раствора. Отсюда и название «щелочные земли».
У атомов химических элементов IIА группы на внешнем слое находится по 2 электрона. В химических реакциях атомы этих элементов выступают в качестве восстановителей, отдавая внешние электроны и превращаясь в ионы с зарядом «2+». Щелочноземельные металлы и их соли окрашивают пламя в разные цвета: например, кальций – в кирпично-красный, стронций – в красный, барий – в зеленый.
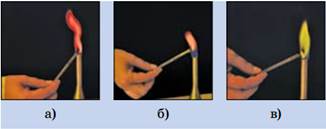
Рис. 1. Окрашивание пламени солями элементов группы IIА: а- солью кальция, б – солью стронция, в- солью бария
2. Нахождение в природе
В виде простых веществ элементы IIА группы в природе не встречаются. Самые распространенные из них – кальций и магний – встречаются в природе в составе минералов, содержащих, как правило, карбонаты и сульфаты этих элементов. Также соли кальция и магния содержатся в пресной и морской воде.
Радий – радиоактивный элемент. В природе он встречается в составе минералов урана.
3. Свойства простых веществ
Теперь рассмотрим химические свойства простых веществ, образованных элементами IIА группы. Простые вещества бериллий, магний и щелочноземельные металлы химически довольно активны. Щелочноземельные металлы нельзя хранить на воздухе, их, как и щелочные металлы, хранят под слоем керосина. Бериллий и магний более устойчивы к воздействию воздуха.
Металлы IIА группы взаимодействуют с кислородом с образованием оксидов и выделением теплоты:
2Ba + O2 = 2BaO + Q

Рис. 2. Горение кальция в кислороде
Как и щелочные металлы, они могут взаимодействовать со многими неметаллами, в том числе с серой, галогенами, фосфором, водородом:
Ca + S = CaS
Mg + Cl2 = MgCl2
3Ca + 2P = Ca3P2
Ba + H2 = BaH2
Щелочноземельные металлы взаимодействуют с водой, при этом образуются щелочи и выделяется водород. Эти реакции являются экзотермическими:
Ba + 2H2O = Ba(OH)2 + H2
Являясь активными металлами, бериллий, магний и щелочноземельные металлы способны реагировать с кислотами, вытесняя из них водород.
Бериллий является переходным элементом. Поэтому простое веществ бериллий способно реагировать не только с кислотами, но со щелочами.
Оксид и гидроксид бериллия обладают амфотерными свойствами: реагируют и с кислотами, и со щелочами:
Be(OH)2 + 2HCl = BeCl2 + H2O
Be(OH)2 + 2NaOH = Na2(Be(OH)4)
4. Свойства сложных веществ
Оксиды и гидроксиды остальных металлов из IIА группы обладают типично основными свойствами. Гидроксид магния – нерастворимое основание. Гидроксиды кальция, стронция, бария и радия – щелочи.
Гидроксиды и карбонаты элементов IIА группы разлагаются при нагревании:
Mg(OH)2 = MgO + H2O
CaCO3 = CaO + CO2
Соли бериллия, стронция, бария и радия ядовиты, а соединения кальция и магния жизненно необходимы живым организмам. Кальций входит в состав скорлупы яиц, «домиков» улиток, костей человека и животных. Магний входит в состав хлорофилла.
Бериллий, магний и щелочноземельные металлы широко применяются в промышленности и технике.
задание: используя материал видеофильма, теоретический материал и параграф 44 охарактеризовать щелочноземельные металлы по плану
Положение в ПС
Строение атома
Степени окисления
Физические свойства
Химические свойства
Нахождение в природе
Соединения
Применение



























