| Ұзақ мерзімді жоспар бөлімі: 9.3А. 17 (VII), 16 (VI), 15 (VI), 14 (IV)-топ элементтеріжәнеолардыңқосылыстары | Школа: 44 ЖОББМ |
| Күні: | Мұғалімнің аты-жөні: Шалабаева Т.М. |
| Сынып: 9 | Қатысқан оқушылар саны: |
| Сабақ тақырыбы | Фосфор және оның қосылыстары |
| Оқу мақсаттары | 9.2.1.22 фосфордыңаллотропиялықтүрөзгерістерінсалыстыру;
9.4.2.2 фосфор қосылыстарыныңҚазақстандағыкенорындарынатау;
9.2.1.23 фосфор жәнеоныңқосылыстарыныңжалпыхимиялыққасиеттерінтүсіндіру. |
| Сабақ мақсаттары | Фосфордың аллотропиялық мақсаттарын салыстыру; Қазақстандағы фосфор қосылыстарының кен орындарын атау; Фосфор және оның қосылыстарының жалпы зимиялық қасиеттерін түсіндіру. |
| Бағалау критерийлері | Біліктілігі: Білу, түсіну, қолдану Оқушы келесі мақсаттарға қол жеткізді, егер: • Фосфордың аллотроптық өзгерісін біледі; • Қазақстандағы фосфор қосылыстарының кен орындарынатайды; • Фосфор және оның қосылыстарының химиялық қасиеттерін сипаттайды. |
| Тілдік мақсаттар
| Пәнаралық лексика және терминология: фосфор, айналым, оксид, улы, молекулярлық, атомдық, су астында сақталады, сәулелендіретін, миға арналған тірі элементтер. |
| Құндылықтарды дамыту | Дәлділік, тазалық, ұқыптылық, тұтастық. |
| Пәнаралық байланыстар | Фосфордың атомдық құрылымын түсіндіретін физикамен байланыс түзу. |
| АКТ қолдану бағыты | Презентация, видео, суреттер, кестелер көрсетіледі. |
| Бастапқы білім | Атом құрылысы; Химиялық реакциялар мысалдары. |
| Сабақ жоспары |
| Сабақтың кезеңдері | Сабақтағы жоспарланған іс-әрекет | Ресурстар |
| Сабақтың басы
| Оқушылармен сәлемдесу, сабаққа дайындықтарын білу
Жаңа сабақ: Конан Дойлдың «Собака Баскервиллей» әңгімесін еске түсірейік. Доктор Ватсон мына затты көрді: “Ол үлкен, қап-қара түсті ит болатын. Оның тұмсығы көгілдір отпен жарқырап жатты, тереңірек орналасқан жабайы көздері от шашып тұрды, моцынынан от жүгіріп өтті. Мен жарқырап жатқан басқа қолымен ұстап, қолымды қайта алғанымда қараңғыда менің де саусақтарымның жарқырағанын көрдім. - Бұл әңгімеде қандай элемент жайлы айтылып жатыр? Бүгінгі сабақтың тақырыбы: фосфор және оның қосылыстары. | Элементтің сипаттамасы | Фосфор | | ХЭПЖ-де орналасуы | 3 период,Vтоп,басты (А)топшасы | | Атом құрылысы | Р +15 )2)8)5 | | Тотығу дәрежелері | +1, +3, +5,-3 |
Табиғи қосылыстары Жоғары химиялық активтілігіне байланысты фосфор табиғатта тек қосылыс түрінде ғана кездеседі. Апатиттердің ең үлкен кен орыны Кола түбегінде, Хабинск таулары аймағында орналасқан. Қазақстанда фосфорит кендері Қаратау таулары аймағында орналасқан. Тапсырмалар Топтарға бөлініңіздер; Қазақстандағы фосфор қосылыстарының кен орындары жайлы ақпарат табыңыздар; Кішігірім постерлер дайындаңыздар; Өз докладтарыңызды түсіндіріңіздер.
Қазақстандағы ақ фосфордың өндірістері Жыл сайын 70 000 тоннадан аса фосфор өндіріледі 
|
PowerPoint презентациясы
Постерлер
|
| Сабақтың ортасы
| Фосфордың аллотроптық модификациялары Элементтік фосфордыңқалыпты жағдайда бірнеше тұрақты аллотроптық түрлері болады; фосфор аллотропиясы жайлы сұрақ өте қиын және аяғана дейін шешілмеген. Әдетте жай заттың төрт модификациясын бөледі — ақ, қызыл, қара және металдық фосфор.
| Заттың сипаттамасы | Ақ фосфор | Қызыл фосфор | Қара фосфор | | 1)Физикалықкүйі | Кристалдық зат | Порошкообразное вещество | Кристаллическое вещество | | 2) Қаттылығы | Қатты емес – пышақпен кесуге болады (су астында) |
| Ақ фосфорға қарағанда қаттырақ | | 3) Түсі | Ақ | Қызыл | Қара | | 4) Иісі | Сарымсақ иісі (Чесночный) | Иісі жоқ | Иісі жоқ | | 5) Судағы ерігіштігі | Ерімейді | Ерімейді | Ерімейді | | 6) Балқу температурасы(0С) | 44 | 260 | 280 | | 7) Жарқырауы | Қараңғыда жарқырайды | Жарқырамайды | Жарқырамайды | | 8) Ағзаға әсері | Қатты улы (кшті у) | Улы емес | Улы емес |
Ақ фосфор қалыпты жағдайдың өзінде оттекпен тотығады, ал жұқалап ұсақталса өздігінен тұтанады, сондықтан оны су ішінде сақтайды. Фосфордың тотығуы жарқыраумен жүреді. Химиялық энергия тікелей жарық энергиясына айналады.
Химиялық қасиеттері
Химиялық реакцияларда тотығу-тотықсыздану екідайлылық көрсетеді. Тотықтырғыш ретінде көптеген металдармен фосфидтер түзу арқылы әрекеттеседі. Фосфор сутекпен тікелей әрекеттеспейді, фосфинді басқа қосымша жолдармен алады. Тотықсыздандырғыш ретінде электртерістілігі жоғары бейметалдармен әрекеттеседі. Оттектің жетіспеушілігінде немесе бөлме температурасында фосфор (III) оксидіне дейін тотығады. Фосфордың оттекте немесе ауада жануы нәтижесінде фосфор (V) оксиді түзіледі.
Ақ фосфордың ауаның қатысынсыз ұзақ уақыт қыздырылуы нәтижесінде ол сарғаяды және ақырындап қызыл фосфорға айналады. Қызыл фосфордың дәл осындай жағдайда қыздырылу нәтижесінде ол буға айналады, ал оны конденсациялағанда қайтадан ақ фосфор түзіледі. Фосфор тотықтырғыш және тотықсыздандырғыш қасиеттер көрсетеді. Фосфор – тотықтырғыш: 2Р + 3Mg = Mg3P2 Фосфиннің алынуы: Mg3P2+6HCl=3MgCl2+2PH3 Фосфор – тотықсыздандырғыш: 3Сl2 + 2P = 2PCl3 PСl3 + Cl2 = PCl5 5О2(артық) + 4Р = 2Р2О5 3О2(жеткіліксіз) + 4Р = 2Р2О3
|
PowerPoint презентациясы
Видеоматериалдар
|
| Сабақтың аяғы
| Фосфор(V) оксиді Р2О5 – ақ ұнтақ, жоғары гигроскопиялық (ең эффективті кептіргіш). Қарапайым қышқылдық оксид. Негіздермен және негіздік оксидтермен әрекеттеседі. Фосфор (V) оксидіне ортофосфор қышқылы сәйкес. Қышқылдық оксидтің қасиеттерін көрсетеді. 1) сумен әрекеттеседі: P2O5 + H2O → 2HPO3 P2O5 + 3H2O 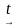 2H3PO4 2H3PO4 2) негіздік оксидтермен әрекеттеседі: P2O5 + 3К2O → 2К3РО4 3) негіздермен әрекеттеседі: P2O5 + 6NaOH → 2Na3РО4 + 3H2O
Ортофосфор қышқылы Алынуы Р2O5 + 3H2O=2H3PO4 Ca3(PO4)2+3H2SO4=3CaSO4+2H3PO4 Қыздырған кездегі фосфор (V) оксидінің сумен әрекеттесуі. Бұл әдіспен тамақ өнеркәсібінде алькогольсіз сусындарға қоспа ретінде пайдаланылатын таза фосфор қышқылын алады. Табиғи фосфаттарды қыздыру арқылы күштірек қышқылдармен ығыстырып шығару. Табиғи фосфаттардың өңделуімен алынған фосфор қышқылы, минералды тыңайтқыштардың өндірісіне жұмсалады.
Тапсырма
Үй тапсырмасы: 1.35,5 г фосфор (V) оксидін 85%-дық 200 мл ортофосфор қышқылының ерітіндісінеқосқан кездегі алынған қышқылдың массалық үлесін табыңыз (p(орт.қышқ.ер.) = 1,7 г/мл). 2. Фосфор оксидтерінің бірінің буының ауа бойынша салыстырмалы тығыздығы 7,6. Фосфор оксидтерінің массалық үлесі 0,564. Оксидтер формуласын анықтаңыз. Рефлексия жүргізу: | Мен не түсіндім? Мен нені үйрендім? | Мен нені толық түсінбедім? | Алдғы уақытта нені үйрену керек? | |
|
|
|
| PowerPoint презентациясы
Қосымша 1
Қосымша 2
|
| Саралау – оқушыларға қалай көбірек қолдау көрсетуді жоспарлайсыз? Қабілеті жоғары оқушыларға қандай міндет қоюды жоспарлап отырсыз? | Бағалау – оқушылардың материалды меңгеру деңгейін қалай тексеруді жоспарлайсыз? | Денсаулық және қауіпсіздік техникасының сақталуы
|
| Барлық оқушылар: реакция теңдеулерін жазады. Тыңдаушылардың көбі: «.» және «х» арқылы молекуланың құрылысын суреттейді. Кейбір оқушылар: фосфор қасиеттерін болжай алады. Үлгерімі төмендеу оқушылар PowerPoint және таратпа материалдырмен қолдау алады. | Мұғалімдер оқушыларды жауаптарының сапасына қарай бағалайды. Топтық жұмыс кезіндегі толық активтілік әрбір оқушының материалды жеке түрде меңгеруіне және оларды толық бағалауға септігін тигізеді. Үй жұмысын тексеру барысында материалды меңгерудің сатысын және сапасын анықтауға болады. | Минуттық жаттығулар жасалыуы балалардың активтілігін арттырады. Сбаққа байланысты қауіпсіздік ережелерінің сақталуы.
|
| Сабақ бойынша рефлексия Сабақ мақсаттары/оқу мақсаттары дұрыс қойылған ба? Оқушылардың барлығы ОМ қол жеткізді ме? Жеткізбесе, неліктен? Сабақта саралау дұрыс жүргізілді ме? Сабақтың уақыттық кезеңдері сақталды ма? Сабақ жоспарынан қандай ауытқулар болды, неліктен? | Бұл бөлімді сабақ туралы өз пікіріңізді білдіру үшін пайдаланыңыз. Өз сабағыңыз туралы сол жақ бағанда берілген сұрақтарға жауап беріңіз. |
|
|
| Жалпы баға
Сабақтың жақсы өткен екі аспектісі (оқыту туралы да, оқу туралы да ойланыңыз)? 1:
2:
Сабақтыжақсартуға не ықпалетеалады (оқытутуралы да, оқутуралы да ойланыңыз)? 1:
2:
Сабақбарысындасыныптуралынемесежекелегеноқушылардыңжетістік/қиындықтарытуралыненібілдім, келесісабақтарда неге көңілбөлуқажет?
|







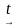 2H3PO4
2H3PO4