
Химия Лекция 6 Электролитическая диссоциация. Ионные реакции

ПЛАН
1. Растворы. Теория электролитической диссоциации. 2. Степень диссоциации. Сильные и слабые электролиты. 3. Среды водных растворов электролитов. Водородный показатель. 4. Ионные реакции.

1. Теория электролитической диссоциации.
Раствор — это однородная система из двух или более компонентов, состав которой можно изменять в определенных пределах без нарушения однородности.
Все растворы можно разделить на неэлектролиты (не проводящие электрический ток) и электролиты (растворы, проводящие электрический ток). К электролитам относятся кислоты, основания и почти все соли. При растворении в воде они распадаются на ионы, движение которых обеспечивает электропроводность растворов этих веществ.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией или ионизацией веществ в растворах.
Возможность распада растворенного вещества на ионы определяется природой растворенного вещества и растворителя. Электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярным типом связи в полярных растворителях. Вода – наиболее сильный ионизирующий растворитель.
![Основные положения теории электролитической диссоциации были разработаны шведским химиком С. Аррениусом (1887) и сводятся к следующему. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — частицы с положительным (катионы) и отрицательным (анионы) зарядом. Ионы могут быть простыми (Na+ , Mg2+, Al3+, и т. д.), сложными ( 2 NH 4 + , NO 3 − , SO 4 − и т. д.) или комплексными: [Zn(NH 3 ) 4 ] 2+ , [Fe(CN) 6 ] 3− и т. д. 2. Под действием электрического поля движение ионов становится направленным: катионы движутся к катоду, анионы — к аноду. 3. Диссоциация — обратимый процесс, поэтому в уравнениях (схемах) диссоциации вместо знака равенства ставится знак обратимости. Краткая схема диссоциации электролита, состоящего из катионов (К) и анионов (А) записывается так: КA К + + A − R К + + A − R](https://fsd.multiurok.ru/html/2021/11/30/s_61a6580d95ba1/img3.jpg)
Основные положения теории электролитической диссоциации были разработаны шведским химиком С. Аррениусом (1887) и сводятся к следующему.
- Электролиты при растворении в воде распадаются (диссоциируют) на ионы — частицы с положительным (катионы) и отрицательным (анионы) зарядом. Ионы могут быть простыми
(Na+ , Mg2+, Al3+, и т. д.), сложными ( 2 NH 4 + , NO 3 − , SO 4 − и т. д.) или комплексными: [Zn(NH 3 ) 4 ] 2+ , [Fe(CN) 6 ] 3− и т. д.
2. Под действием электрического поля движение ионов становится направленным: катионы движутся к катоду, анионы — к аноду.
3. Диссоциация — обратимый процесс, поэтому в уравнениях (схемах) диссоциации вместо знака равенства ставится знак обратимости. Краткая схема диссоциации электролита, состоящего из катионов (К) и анионов (А) записывается так:
КA К + + A − R
К + + A − R

Теория электролитической диссоциации согласуется с атомно-молекулярным учением, строением атомов и результатами экспериментальных исследований.
Теория Аррениуса не объясняет механизма электролитической диссоциации, так как её автор находился на позициях физической теории и не связывал распад на ионы электролитов с их взаимодействием с растворителем. Причину электролитической диссоциации объяснили российские химики И. А. Каблуков и В. А. Кистяковский (1890 – 1891), которые опирались на химическую теорию растворов Д.И. Менделеева (1887).

Легче всего и практически нацело диссоциируют вещества с ионной связью, состоящие из ионов. При их растворении полярные молекулы воды, являющиеся диполями, притягиваются к поверхностным ионам вещества, ориентируясь по отношению к ним противоположно заряженными полюсами.
В результате взаимодействие между ионами электролита ослабляется, происходит разрыв химических связей между ионами и ионы переходят в раствор в гидратированном состоянии (гидратированные ионы).

Несколько иной механизм диссоциации у электролитов, молекулы которых образованы ковалентно-полярными связями. В этом случае диполи воды ориентируются вокруг каждой полярной молекулы растворимого вещества. В результате происходит дополнительная поляризация связи, полярная молекула превращается в ионную, которая легко распадается на гидратированные ионы.
Распад на ионы ковалентно-полярных веществ называется ионизацией, а сами вещества — потенциальными электролитами. Ионные соединения, которые в твердом состоянии образуют ионную кристаллическую решетку (типичные соли), называются настоящими (истинными) электролитами.
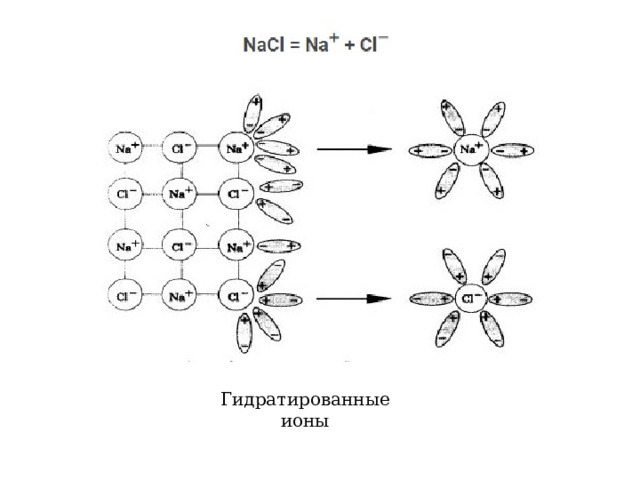
Гидратированные ионы

2. Степень диссоциации. Сильные и слабые электролиты.
Для количественной характеристики обратимого процесса электролитической диссоциации используется понятие степени ЭД.
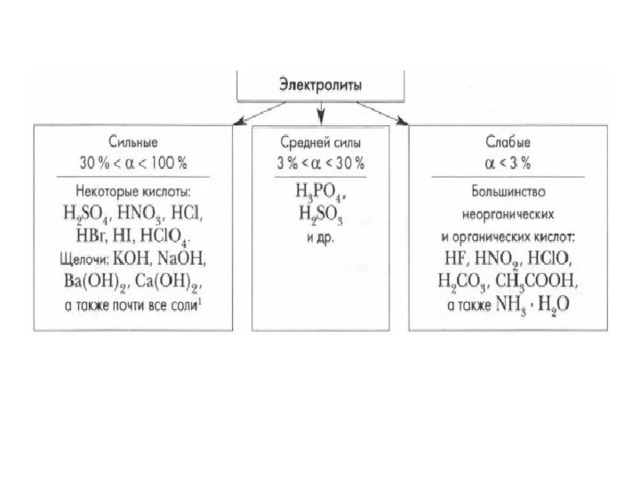
Степень диссоциации (α) показывает, какая доля от общего количества электролита распадается на ионы. Ее выражают в долях от единицы или в процентах. Численное значение α варьируется в широких пределах от нуля (неэлектролиты) до 1 (или 100 %) в случае полной диссоциации электролита. Степень диссоциации зависит от природы электролита и растворителя, от концентрации и температуры раствора.
По значению степени диссоциации электролиты классифицируют на сильные, средней силы и слабые .
![3. Среды водных растворов электролитов. Водородный показатель. Различают три типа сред водных растворов электролитов: нейтральную, кислую и щелочную. Для характеристики сред растворов используют водородный показатель рН (ввел понятие датский химик Сёренсен). « р » - начальная буква слова potenz- математическая степень, « Н » - химический знак водорода. Водородным показателем называется отрицательный десятичный логарифм концентрации ионов водорода. рН = - lg [H + ] меньше 7 - среда кислая, =7 среда нейтральная, больше 7 – среда щелочная](https://fsd.multiurok.ru/html/2021/11/30/s_61a6580d95ba1/img10.jpg)
3. Среды водных растворов электролитов. Водородный показатель.
Различают три типа сред водных растворов электролитов: нейтральную, кислую и щелочную.
Для характеристики сред растворов используют водородный показатель рН (ввел понятие датский химик Сёренсен). « р » - начальная буква слова potenz- математическая степень, « Н » - химический знак водорода.
Водородным показателем называется отрицательный десятичный логарифм концентрации ионов водорода.
рН = - lg [H + ]
меньше 7 - среда кислая, =7 среда нейтральная, больше 7 – среда щелочная

4. Ионные реакции.
Реакции, протекающие между ионами, называются ионными реакциями . При написании ионных уравнений пользуются таблицей растворимости, где указаны катионы и анионы и растворимость образуемых ими веществ.
Ионные реакции могут быть обратимыми, но могут идти и до конца (по правилу Бертолле).
Составим молекулярное уравнение реакции между гидроксидом железа (III) и азотной кислотой. Расставим коэффициенты.
Fe(OH) 3 + 3HNO 3 = Fe(NO 3 ) 3 + 3H 2 O

Запишем данное уравнение в полной ионной форме:
(гидроксид железа (III) является нерастворимым снованием, поэтому не подвергается электролитической диссоциации.
Вода – малодиссоциирующее вещество, на ионы в растворе практически не распадается.)
Fe(OH) 3 + 3H + + 3NO 3 - = Fe 3+ + 3NO 3 - + 3H 2 O
Зачеркнем одинаковое количество нитрат-анионов слева и справа, запишем сокращенное ионное уравнение:
Fe(OH) 3 + 3H + = Fe 3+ + 3H 2 O
Данная реакция протекает до конца, т.к. образуется малодиссоциирующее вещество – вода.

Задания для самостоятельной работы
Учебник О. С. Габриелян, Г. Г. Лысова
«Химия 11 класс, базовый уровень»
Стр. 156, №№ 3, 4, 8, 9, 10, 11.











![Основные положения теории электролитической диссоциации были разработаны шведским химиком С. Аррениусом (1887) и сводятся к следующему. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — частицы с положительным (катионы) и отрицательным (анионы) зарядом. Ионы могут быть простыми (Na+ , Mg2+, Al3+, и т. д.), сложными ( 2 NH 4 + , NO 3 − , SO 4 − и т. д.) или комплексными: [Zn(NH 3 ) 4 ] 2+ , [Fe(CN) 6 ] 3− и т. д. 2. Под действием электрического поля движение ионов становится направленным: катионы движутся к катоду, анионы — к аноду. 3. Диссоциация — обратимый процесс, поэтому в уравнениях (схемах) диссоциации вместо знака равенства ставится знак обратимости. Краткая схема диссоциации электролита, состоящего из катионов (К) и анионов (А) записывается так: КA К + + A − R К + + A − R](https://fsd.multiurok.ru/html/2021/11/30/s_61a6580d95ba1/img3.jpg)






![3. Среды водных растворов электролитов. Водородный показатель. Различают три типа сред водных растворов электролитов: нейтральную, кислую и щелочную. Для характеристики сред растворов используют водородный показатель рН (ввел понятие датский химик Сёренсен). « р » - начальная буква слова potenz- математическая степень, « Н » - химический знак водорода. Водородным показателем называется отрицательный десятичный логарифм концентрации ионов водорода. рН = - lg [H + ] меньше 7 - среда кислая, =7 среда нейтральная, больше 7 – среда щелочная](https://fsd.multiurok.ru/html/2021/11/30/s_61a6580d95ba1/img10.jpg)
























