Соли
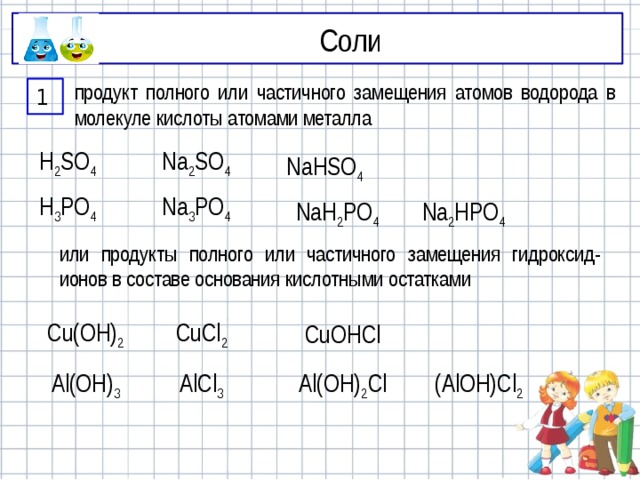
Соли
1
продукт полного или частичного замещения атомов водорода в молекуле кислоты атомами металла
H 2 SO 4
Na 2 SO 4
NaHSO 4
Na 3 PO 4
H 3 PO 4
NaH 2 PO 4
Na 2 HPO 4
или продукты полного или частичного замещения гидроксид-ионов в составе основания кислотными остатками
Cu(OH) 2
CuCl 2
CuOHCl
Al(OH) 3
AlCl 3
Al(OH) 2 Cl
(AlOH)Cl 2

Соли
1
Средние соли
продукт полного замещения атомов водорода в молекуле кислоты атомами металла
Na 2 CO 3
Na 3 PO 4
Ca 3 (PO 4 ) 2
Na 2 SO 4
или продукты полного гидроксид-ионов в составе основания кислотными остатками
CuCl 2
AlCl 3
MgSO 4
электролиты, которые при диссоциации образуют катионы металлов и анионы кислотных остатков
Средние соли
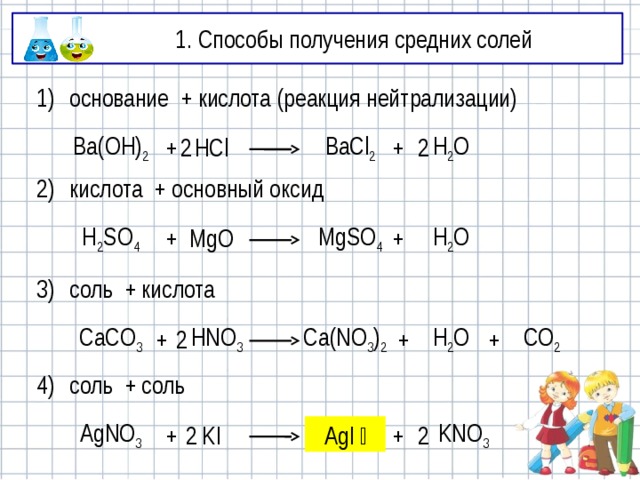
1. Способы получения средних солей
1)
основание + кислота (реакция нейтрализации)
+
2
2
H 2 O
BaCl 2
HCl
+
Ba(OH) 2
2)
кислота + основный оксид
H 2 SO 4
+
MgO
MgSO 4
+
H 2 O
3)
соль + кислота
CaCO 3
+
HNO 3
Ca(NO 3 ) 2
+
H 2 O
+
CO 2
2
4)
соль + соль
AgNO 3
+
KI
AgI ↆ
+
KNO 3
AgI ↆ
2
2

1. Способы получения средних солей
CuSO 4
+
H 2 S
CuS
+
H 2 SO 4
ZnSO 4
+
H 2 S
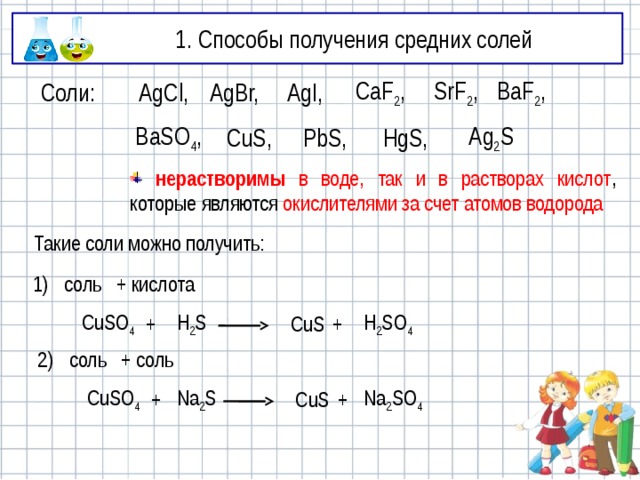
1. Способы получения средних солей
CaF 2 ,
BaF 2 ,
SrF 2 ,
AgI,
AgBr,
AgCl,
Соли:
BaSO 4 ,
CuS,
PbS,
HgS,
Ag 2 S
- нерастворимы в воде, так и в растворах кислот , которые являются окислителями за счет атомов водорода
Такие соли можно получить:
1)
соль + кислота
CuSO 4
+
H 2 S
CuS
+
H 2 SO 4
2)
соль + соль
CuSO 4
+
Na 2 S
CuS
+
Na 2 SO 4

1. Способы получения средних солей
FeS,
MnS,
ZnS,
BaCO 3 ,
Ca 3 (PO 4 ) 2 ,
Соли:
MgCO 3
CaCO 3 ,
- нерастворимы в воде , но растворимы в кислотах
Такие соли можно получить:
1)
соль + соль
NaCl
2
Na 2 S
+
ZnS
+
ZnCl 2
Нельзя получить:
соль + кислота
ZnCl 2
+
H 2 S

1. Способы получения средних солей
5)
соль + кислотный оксид
(менее летучие оксиды вытесняют из солей более летучие)
SO 2
CaSO 3
+
SiO 2
CaSiO 3
+
Na 2 CO 3
+
SiO 2
Na 2 SiO 3
+
CO 2
основание + кислотный оксид
6)
NaOH
+
P 2 O 5
Na 3 PO 4
+
H 2 O
6
2
3
7)
Основание + соль
NaOH
+
FeCl 3
Fe(OH) 3
+
NaCl
3
3
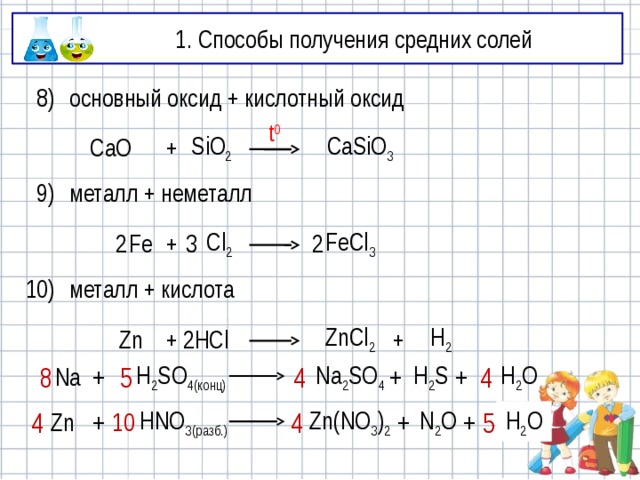
1. Способы получения средних солей
8)
основный оксид + кислотный оксид
t 0
CaO
+
SiO 2
CaSiO 3
металл + неметалл
9)
+
Cl 2
FeCl 3
2
2
3
Fe
10)
металл + кислота
ZnCl 2
2
H 2
+
+
Zn
HCl
+
4
8
4
H 2 O
5
H 2 S
Na 2 SO 4
H 2 SO 4(конц)
+
Na
+
H 2 O
10
4
4
+
Zn(NO 3 ) 2
+
N 2 O
+
HNO 3(разб.)
Zn
5

1. Способы получения средних солей
11)
металл + соль
Cu
+
Hg(NO 3 ) 2
Hg
+
Cu(NO 3 ) 2
Cu
+
Mg
MgSO 4
CuSO 4
+
AgNO 3
+
Fe
Fe(NO 3 ) 2
+
Ag
MgSO 4
+
Fe

1. Способы получения средних солей
12)
Металлы (Zn, Al, Be, Sn, Pb) + расплавы щелочей соль + Н 2
t 0
H 2
+
Na 2 ZnO 2
2
Zn
+
NaOH
Zn
Zn(OH) 2
ZnO 2 H 2
H 2 ZnO 2
NaOH
Na 2 ZnO 2
H 2 O
+
H 2 ZnO 2
+
t 0
NaAlO 2
2
2
H 2
+
2
Al
+
NaOH
-H 2 O
Al(OH) 3
Al
H 3 AlO 3
HAlO 2
AlO 3 H 3
HAlO 2
+
NaAlO 2
+
H 2 O
NaOH

1. Способы получения средних солей
13)
неметаллы + щелочи
H 2 O
2
6
3
3
+
Na 2 SO 3
+
Na 2 S
S
+
NaOH
2
H 2 O
+
+
NaClO
NaCl
NaOH
+
Cl 2
t 0
3
5
H 2 O
3
6
+
+
NaCl
NaOH
NaClO 3
+
Cl 2
14)
неметаллы + соль
NaBr
Br 2
NaCl
Cl 2
+
+
Cl
2
2
Br
Cl 2
I 2
+
NaCl
+
NaI
2
2
I
NaI
+
Br 2
NaBr
+
I 2
2
2
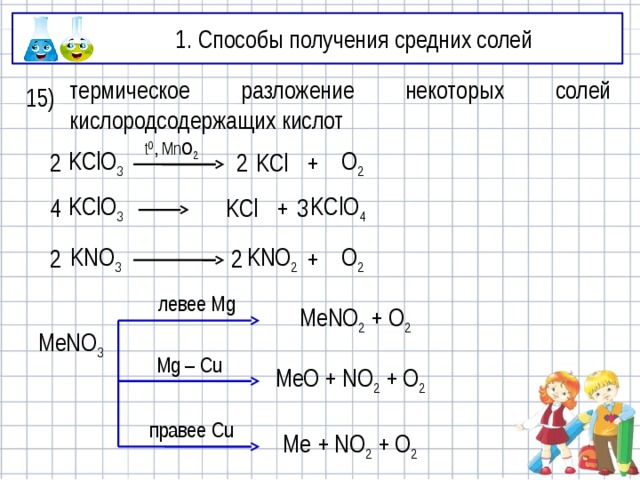
1. Способы получения средних солей
15)
термическое разложение некоторых солей кислородсодержащих кислот
t 0 , MnO 2
KClO 3
KCl
+
O 2
2
2
KClO 4
3
4
KCl
+
KClO 3
KNO 3
KNO 2
+
O 2
2
2
левее Mg
MeNO 2 + O 2
MeNO 3
Mg – Cu
MeO + NO 2 + O 2
правее Cu
Me + NO 2 + O 2

1. Способы получения средних солей
16)
окисление или восстановление некоторых солей
FeCl 2
+
Cl 2
FeCl 3
2
2
FeCl 2
3
2
+
FeCl 3
Fe
Na 2 SO 4
2
2
O 2
+
Na 2 SO 3
FeCl 3
+
Cu
FeCl 2
+
CuCl 2
2
2

Химические свойства средних солей
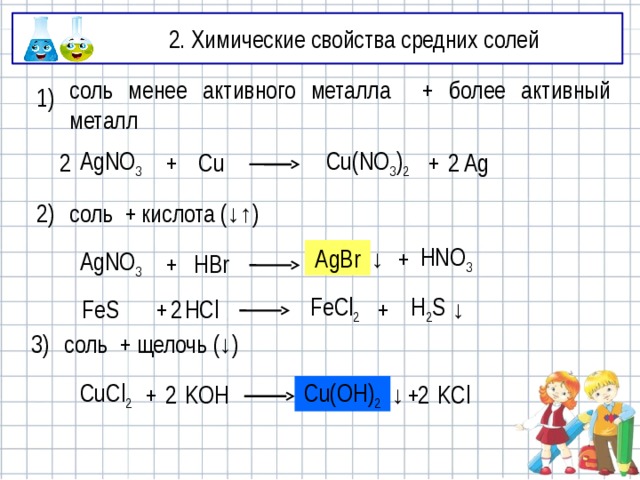
2. Химические свойства средних солей
1)
соль менее активного металла + более активный металл
+
2
2
Ag
Cu(NO 3 ) 2
Cu
+
AgNO 3
2)
соль + кислота (↓↑)
+
AgBr
HNO 3
↓
AgBr
HBr
+
AgNO 3
+
2
H 2 S
↓
FeCl 2
HCl
+
FeS
3)
соль + щелочь (↓)
KCl
↓
2
2
KOH
+
Cu(OH) 2
+
CuCl 2
Cu(OH) 2
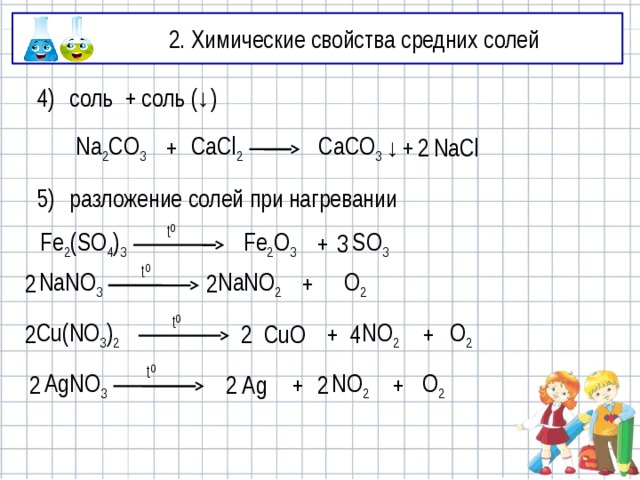
2. Химические свойства средних солей
4)
соль + соль (↓)
+
2
NaCl
↓
CaCO 3
Na 2 CO 3
CaCl 2
+
5)
разложение солей при нагревании
t 0
Fe 2 (SO 4 ) 3
Fe 2 O 3
+
SO 3
3
t 0
O 2
2
2
NaNO 2
+
NaNO 3
t 0
+
4
2
O 2
2
NO 2
+
CuO
Cu(NO 3 ) 2
t 0
AgNO 3
Ag
+
NO 2
+
O 2
2
2
2
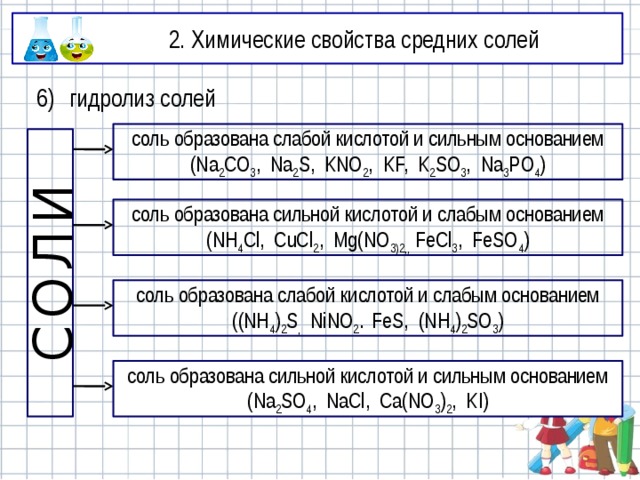
2. Химические свойства средних солей
6)
гидролиз солей
соль образована слабой кислотой и сильным основанием (Na 2 CO 3 , Na 2 S, KNO 2 , KF, K 2 SO 3 , Na 3 PO 4 )
СОЛИ
соль образована сильной кислотой и слабым основанием (NH 4 Cl, CuCl 2 , Mg(NO 3)2,, FeCl 3 , FeSO 4 )
соль образована слабой кислотой и слабым основанием ((NH 4 ) 2 S , NiNO 2 . FeS, (NH 4 ) 2 SO 3 )
соль образована сильной кислотой и сильным основанием (Na 2 SO 4 , NaCl, Ca(NO 3 ) 2 , KI)
 [H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
[H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
2. Химические свойства средних солей
1)
соль образована слабой кислотой и сильным основанием (Na 2 CO 3 , Na 2 S, Ca(NO 2 ) 2 , KF, K 2 SO 3 , Na 3 PO 4 )
1)
Na 2 CO 3
2
CO 3 2-
2)
Na 2 CO 3
=
Na +
+
H +
+
OH
H 2 O
H 2 CO 3
NaOH
(сильное основание)
(слабая кислота)
(слабая кислота)
(сильное основание)
HCO 3
+
OH
H 2 O
+
CO 3 2-
3)
4)
Вывод:
1)
[OH ] [H + ], pH7, среда щелочная
2)
гидролиз по аниону

2. Химические свойства средних солей
+
2Na +
+
HCO 3
OH
2Na +
+
H 2 O
+
CO 3 2-
Na 2 CO 3
+
H 2 O
NaOH
+
NaHCO 3

2. Химические свойства средних солей
Чтобы усилить гидролиз:
1)
добавить воды (уменьшить концентрацию)
2)
нагреть раствор (усиление диссоциации воды)
3)
связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу

2. Химические свойства средних солей
Чтобы уменьшить гидролиз:
1)
увеличить концентрацию растворенного вещества
2)
охладить раствор
3)
ввести в раствор один из продуктов гидролиза
а)
подкислять, если среда кислая
б)
подщелачивать, если среда щелочная
 [H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
[H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
2. Химические свойства средних солей
1)
соль образована слабой кислотой и сильным основанием (Na 2 CO 3 , Na 2 S, Ca(NO 2 ) 2 , KF, K 2 SO 3 , Na 3 PO 4 )
1)
Na 2 S
2
S 2-
2)
Na 2 S
=
Na +
+
H +
+
OH
H 2 O
H 2 S
NaOH
(сильное основание)
(слабая кислота)
(слабая кислота)
(сильное основание)
HS
+
OH
H 2 O
+
S 2-
3)
4)
Вывод:
1)
[OH ] [H + ], pH7, среда щелочная
2)
гидролиз по аниону

2. Химические свойства средних солей
+
2Na +
+
HS
OH
2Na +
+
H 2 O
+
S 2-
Na 2 S
+
H 2 O
NaOH
+
NaHS
 [H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
[H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
2. Химические свойства средних солей
1)
соль образована слабой кислотой и сильным основанием (Na 2 CO 3 , Na 2 S, Ca(NO 2 ) 2 , KF, K 2 SO 3 , Na 3 PO 4 )
1)
KNO 2
NO 2 -
+
2)
KNO 2
=
K +
H +
+
OH
H 2 O
HNO 2
KOH
(сильное основание)
(слабая кислота)
(слабая кислота)
(сильное основание)
HNO 2
+
OH
H 2 O
+
NO 2 -
3)
4)
Вывод:
1)
[OH ] [H + ], pH7, среда щелочная
2)
гидролиз по аниону
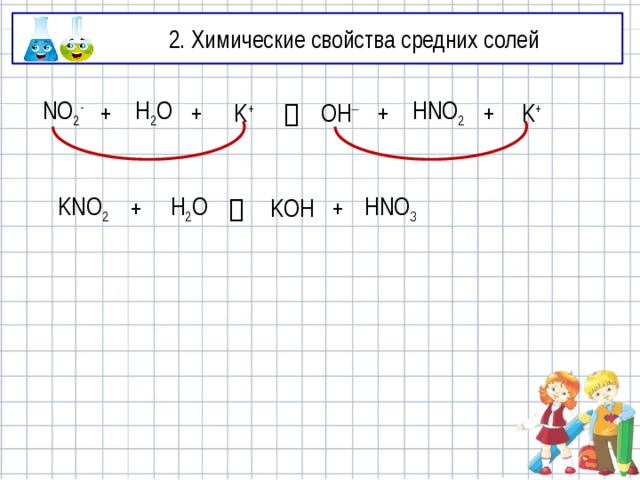
2. Химические свойства средних солей
+
K +
+
HNO 2
OH
K +
+
H 2 O
+
NO 2 -
KNO 2
+
H 2 O
KOH
+
HNO 3

2. Химические свойства средних солей

2. Химические свойства средних солей

Домашнее задание
§ 22

























 [H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
[H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"



 [H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
[H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"

 [H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"
[H + ], pH7, среда щелочная 2) гидролиз по аниону " width="640"























