
ГАПОУ СО «Калининский техникум агробизнеса»
Подготовила: преподаватель химии
высшей квалификационной категории
Данилова Таисия Викторовна

Основные «противоречия»
органической химии
- Многообразие веществ, которые образованы небольшим числом элементов;
- Кажущееся несоответствие понятий валентности и степени окисления в органических веществах – С 3 Н 8 ;
- Различные физические и химические свойства соединений, имеющих одинаковую молекулярную формулу:
С 6 Н 12 О 6 – глюкоза, фруктоза;
- С 6 Н 12 О 6 – глюкоза, фруктоза;
С 2 Н 6 О – этиловый спирт, диметиловый эфир

Теория радикалов
(30 гг. XIX в Й.Берцелиус , Ю.Либих, Ж.Дюма)
- В состав органических веществ входят радикалы ;
- Радикалы всегда постоянны, не подвергаются изменениям, переходят из одной молекулы в другую;
- Радикалы могут существовать в свободном виде.
Понятие «радикал» прочно вошло в химию

Теория типов
(40-50 гг. XIX в. Ш.Жерар, А.Кекуле и др.)
- Все органические вещества – производные простейших неорганических – типа водорода, воды, аммиака и др.
- Формулы выражают не внутреннее строение молекулы, а способы образования, свойства определяют все атомы молекулы;
Недостатки: Теория позволила классифицировать орг. вещества, но зашла в тупик по мере накопления экспериментального материала. Невозможно предсказать свойства вещества на основе строения его молекулы. У каждого вещества столько формул, сколько его превращений существует.

«Органическая химия может сейчас кого угодно свести с ума. Она представляется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть…»
(из письма Ф.Велера к Й.Берцелиусу 1835г.)

Научные предпосылки возникновения теории
- Развитие и утверждение атомистических представлений ( съезд в Карслруэ, 1860г.);
- Установление понятия «валентность» (Э. Франкленд, 1853г.);
- Понятие четырехвалентности углерода (А. Кекуле, 1858г.);
- Идеи о соединении атомов углерода в цепи (А. Кекуле, А. Купер, 1857г.)
Т.о. до Бутлерова целостной теории, подтвержденной экспериментом, не существовало.

Основные положения теории строения органических веществ
(А.М. Бутлеров 1861 – 1864 гг.)
1. Атомы в молекулах органический веществ соединены в определенной последовательности согласно их валентности. Эту последовательность Бутлеров назвал ХИМИЧЕСКИМ СТРОЕНИЕМ.
Углерод в органических соединениях всегда ЧЕТЫРЕХВАЛЕНТЕН, а его атомы способны соединяться друг с другом, образуя различные цепи. Химическое строение молекул может быть отображено при помощи структурных формул.

2. Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т.е. химическим строением вещества. Различное строение при одном и том же составе и относительной молекулярной массе вещества объясняет явление изомерии.
3. Свойства органических соединений зависят от взаимного влияния атомов и групп атомов в молекуле друг на друга. Наибольшее влияние оказывают атомы, непосредственно связанные друг с другом. Влияние атомов или групп атомов, не связанных непосредственно, ослабевает по мере их удаления друг от друга.
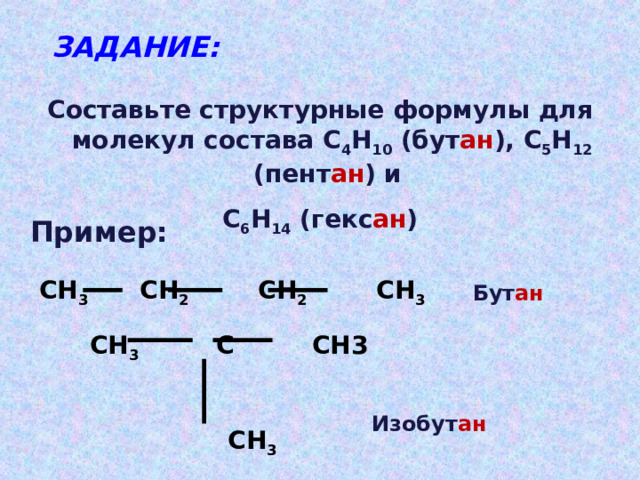
ЗАДАНИЕ:
Составьте структурные формулы для молекул состава С 4 Н 10 (бут ан ), С 5 Н 12 (пент ан ) и
С 6 Н 14 (гекс ан )
Пример:
СН 3 СН 2 СН 2 СН 3
Бут ан
СН 3 С СН3
СН 3
Изобут ан

Трансформация изомеров пентана

4. Зная строение вещества, можно предположить его свойства. И наоборот, зная свойства вещества, можно предположить его строение.
СН 3 СН 2 ОН этиловый спирт
С 2 Н 6 О
СН 3 О СН 3 диметиловый эфир
Если известно, что вещество, имеющее молекулярную формулу С 2 Н 6 О, вступает в химические реакции, характерные для спиртов (выделяет водород в реакции с металлическим натрием), то можно сделать вывод, что мы говорим об этиловом спирте С 2 Н 5 ОН.

Направления современного развития теории Бутлерова
1. Развитие представлений о строении молекул: свойства вещества можно объяснить на основе не только химического, но и электронного и пространственного строения его молекул.
2. Развитие представлений об изомерии: современная органическая химия различает 2 основных типа изомерии : структурную (изомерия цепи, положения кратных связей, функциональных групп, гомологических рядов) и стереоизомерию ( геометрическую , или цис-транс-изомерию и оптическую , или зеркальную).

Направления современного развития теории Бутлерова
3. Превращение органической химии из описательной науки в созидательную, прогнозирующую; возможно предсказание, а затем синтез веществ с заранее заданными свойствами.
4. Создание искусственных аналогов природных веществ, которые могут даже превосходить природные по свойствам (синтетические красители, каучуки, пластмассы, волокна).

Значение теории химического строения А. М. Бутлерова для органической химии можно сравнить со значением Периодического закона и Периодической системы химических элементов Д. И. Менделеева для неорганической химии.

Подведем итоги:
1) Что такое изомерия? Изомеры?
2) Что такое гомология? Гомологи?
3) Что понимают под химическим строением органических соединений?
4) Сформулируйте положение теории строения, которое объясняет различие в свойствах изомеров.
5) Назовите причины многообразия органических веществ.

Домашнее задание:
Базовый: §2, упр.2,8,11 письменно;
вопросы 1,3- 6 устно
Профильный: §2, все задания из
презентации
Подготовиться к стартовой работе!

К стартовой работе необходимо:
ЗНАТЬ
1.Формулировку 1-го и 2-го положений теории Бутлерова;
2. Определения гомологов (гомологии), изомеров (изомерии), валентности, степени окисления, химического строения; подкреплять их примерами.
УМЕТЬ
- Изображать структурные формулы органических соединений согласно валентности элементов;
- Объяснять причины многообразие органических соединений.
ПОВТОРИТЬ
- Типы химических связей, основные типы реакций;
- Строение атомов 1-3 периодов;
- Простейшие расчеты по уравнению.
ТЕСТЫ: 3.20,3.22,3.24,3.26 (эл. приложение проф.)
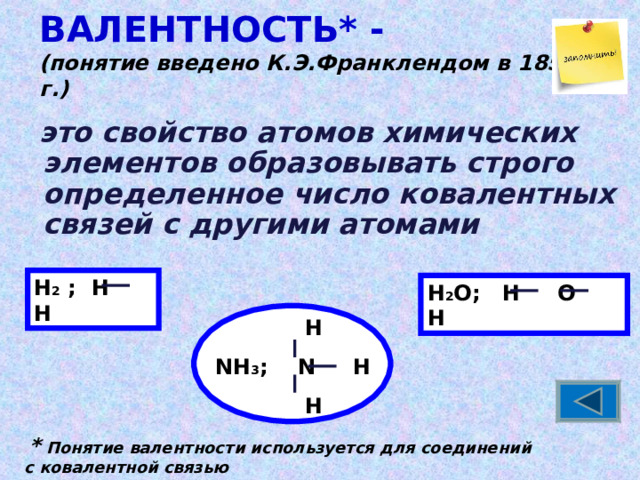
ВАЛЕНТНОСТЬ* - (понятие введено К.Э.Франклендом в 1853 г.)
это свойство атомов химических элементов образовывать строго определенное число ковалентных связей с другими атомами
Н 2 ; Н Н
Н 2 О; Н О Н
H
NH 3 ; N H
H
* Понятие валентности используется для соединений
с ковалентной связью

СТЕПЕНЬ ОКИСЛЕНИЯ* -
это условный заряд атома в соединении, вычисленный исходя из предположения,
что вещество состоит из ионов
* Понятие степени окисления более
характерно для соединений с ионной связью
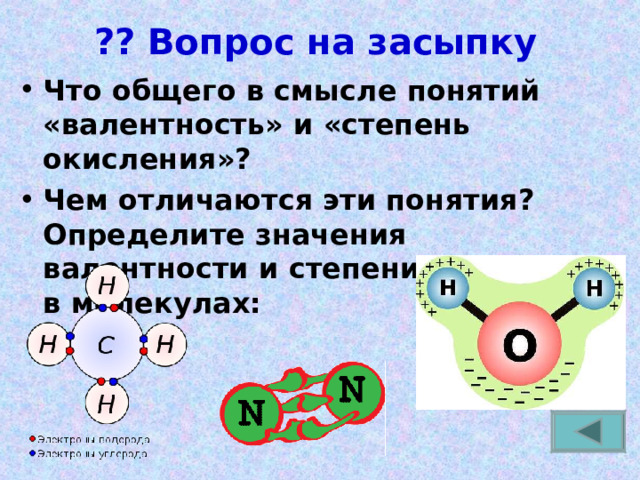
?? Вопрос на засыпку
- Что общего в смысле понятий «валентность» и «степень окисления»?
- Чем отличаются эти понятия? Определите значения валентности и степени окисления в молекулах:
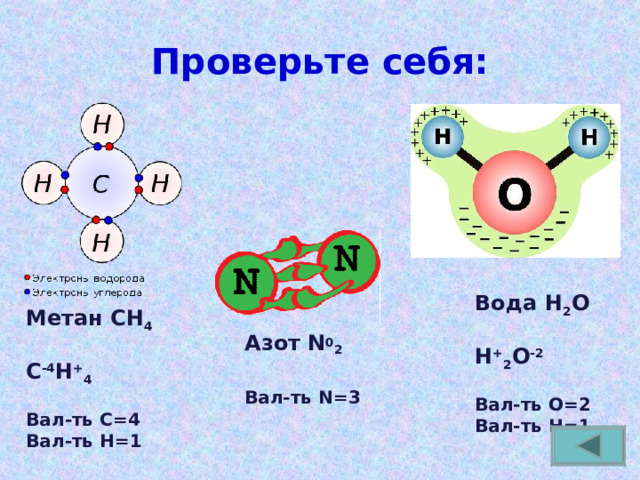
Проверьте себя:
Вода Н 2 О
Н + 2 О -2
Вал-ть О=2
Вал-ть Н=1
Метан СН 4
С -4 Н + 4
Вал-ть С=4
Вал-ть Н=1
Азот N 0 2
Вал-ть N = 3

Вещества, которые имеют один и тот же качественный и количественный составы, но отличаются по своему строению и свойствам, называются изомерами , а явление существования таких веществ носит название изомерии
СН 3 СН СН 3
СН 3
СН 3 СН 2 СН 2 СН 3
БУТАН (С 4 Н 10 )
( t кип. = - 0,5 С)
ИЗОБУТАН (С 4 Н 10 )
( t кип. = -11,7 С)
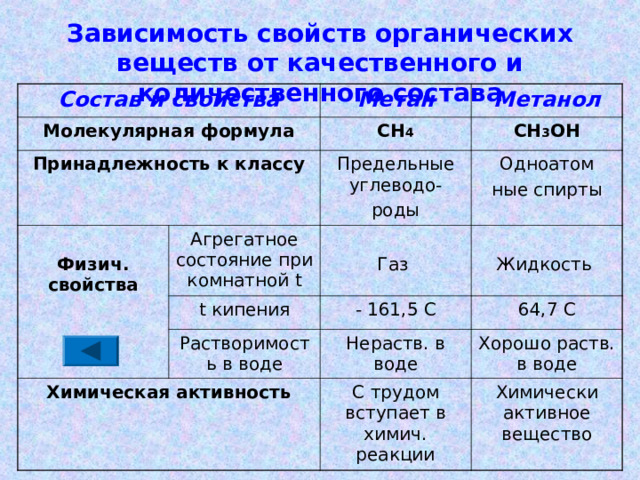
Зависимость свойств органических веществ от качественного и количественного состава
Состав и свойства
Молекулярная формула
Принадлежность к классу
Метан
Метанол
СН 4
Физич. свойства
СН 3 ОН
Предельные углеводо-
роды
Агрегатное состояние при комнатной t
Одноатом
ные спирты
Газ
t кипения
Растворимость в воде
Жидкость
- 161,5 С
Химическая активность
64,7 С
Нераств. в воде
Хорошо раств. в воде
С трудом вступает в химич. реакции
Химически активное вещество

Франкленд (Frankland) Эдуард (1825-99), английский химик-органик, иностранный член-корреспондент Петербургской АН (1876). Ввел термин «валентность» (1853).

Бутлеров Александр Михайлович (1828-86), российский химик-органик, академик Петербургской АН (1874). Создал (1861) и обосновал теорию химического строения, согласно которой свойства веществ определяются порядком связей атомов в молекулах и их взаимным влиянием. Первым объяснил (1864) явление изомерии. Открыл полимеризацию изобутилена. Синтезировал ряд органических соединений (уротропин, полимер формальдегида и др.). Труды по сельскому хозяйству, пчеловодству. Поборник высшего образования для женщин.

Кстати…
Создатель теории химического строения Александр Бутлеров стал виновником пожара в Казанском университете, студентом которого он являлся в те годы. В наказание незадачливого экспериментатора заставили повесить на себя табличку «великий химик» и пройти в таком виде перед всеми учениками. Это унижение не отвратило молодого человека от его любимого предмета, и через некоторое время Бутлерову действительно удалось стать великим химиком.

Берцелиус (Berzelius) Йенс Якоб (1779-1848), шведский химик и минералог, иностранный почетный член Петербургской АН (1820). Открыл церий (1803), селен (1817), торий (1828). Создал (1812-19) электрохимическую теорию химического сродства, на ее основе построил классификацию элементов, соединений и минералов. Определил (1807-18) атомные массы 45 элементов, ввел (1814) современные химические знаки элементов. Предложил термин «катализ».

Кекуле (Kekule) Фридрих Август (1829-96), немецкий химик-органик, иностранный член-корреспондент Петербургской АН (1887). Труды по теории строения органических соединений. Показал, что углерод четырехвалентен (1857) и его атомы могут соединяться друг с другом в цепи (1858). Предложил (1865) циклическую формулу бензола.

Велер Фридрих (1800-82), немецкий химик, иностранный член-корреспондент Петербургской АН (1853). Впервые синтезировал из неорганических веществ органическое соединение (1824) и установил его тождество с мочевиной (1828). Исследования Велера поставили под сомнение правоту витализма.
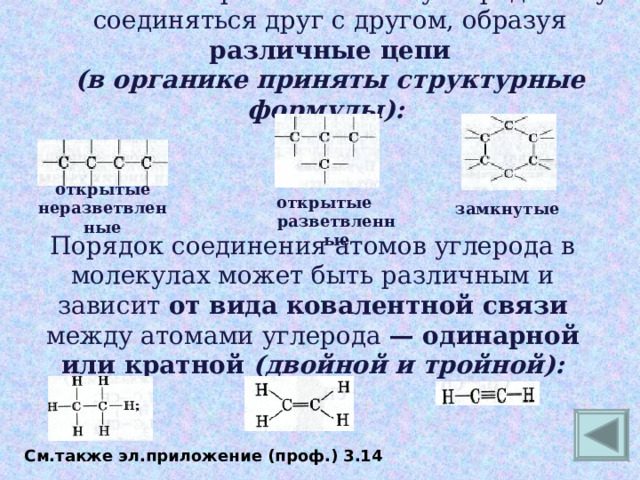
Атомы четырехвалентного углерода могут соединяться друг с другом, образуя различные цепи
(в органике приняты структурные формулы):
открытые неразветвленные
открытые разветвленные
замкнутые
Порядок соединения атомов углерода в молекулах может быть различным и зависит от вида ковалентной связи между атомами углерода — одинарной или кратной (двойной и тройной):
См.также эл.приложение (проф.) 3.14

ВИДЫ ИЗОМЕРИИ
1. Структурная изомерия – молекулы веществ различаются порядком связи атомов в молекулах:
1) изомерия углеродной цепи (скелета)
н - бутан
изобутан (2-метилпропан)
2) изомерия положения
б) заместителей
а) кратных связей:
бутен-1
1-хлорпропан
2-хлорпропан
в) изомерия положения функциональных групп
3) изомерия гомологических рядов (межклассовая)
бутен-2

ВИДЫ ИЗОМЕРИИ
2. Пространственная (стереоизомерия) – молекулы веществ различаются не порядком связи атомов в молекулах, а положением атомов в пространстве ( цис-транс-изомерия или геометрическая ).

























































