Строение.
Свойства.
Функции.
Елисеева Г.Н. МОУ СОШ №9

- Белки называют также протеинами (греч. Protos – первый, главный).
Белки - сложные высокомолекулярные природные соединения, построенные из остатков α -аминокислот.

После удаления воды, в сухом остатке на 1 месте по содержанию веществ в клетке стоят белки. .


В состав белков входят: С, Н, О, N , S . Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.

Классификация белков
белки
простые
сложные
состоят из остатков аминокислот
кроме аминокислот содержат небелковую - простетическую группу:
атомы металла – металлопротеины
молекулу липида – липопротеины
молекулу углевода – гликопротеины
остаток фосфорной кислоты – фосфопротеины
молекулу нуклеиновой кислоты – нуклеопротеины

Строение белков.
- Макромолекулы -органические соединения, характеризующиеся большими размерами молекул.
- Полимеры - молекулы, состоящие из большого количества молекул.

- Цепи из небольшого числа аминокислотных остатков – пептиды , а цепи состоящие более чем из 10 аминокислотных остатков называются полипептиды или белки.
- Белки – нерегулярные полимеры ( гетерополимеры ) , мономерами которых являются аминокислоты .
- А-Б-В-А-Г-Б-А-В-А-А-А-Б-С-Е-Д

Аминокислоты
- В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления белков пищи пищеварительными ферментами или собственных запасных белков. Природных аминокислот –150, в белки входят –20.

Аминокислоты
Заменимые
синтезируются в организме
Незаменимые
в организме не синтезируются
- Заменимые синтезируются в организме. Углеродный скелет аминокислот образуется из глюкозы, а
универсальным донором аминогруппы служит глутаминовая кислота.

Незаменимые аминокислоты
- Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан, иногда в их число включают гистидин и аргинин.
- В зависимости от аминокислотного состава , белки бывают:
- полноценными – белки, содержащие весь набор аминокислот (20 разных аминокислот);
- неполноценными – белки, в составе которых какие-то аминокислоты отсутствуют.

- В состав большинства белков входят 300–500 аминокислотных остатков, но есть и более крупные белки, состоящие из 1500 и более аминокислот. Белки различаются и составом аминокислот и числом аминокислотных звеньев, и особенно порядком чередования их в полипептидных цепях. Расчет показывает, что для белка, построенного из 20 различных аминокислот, содержащего в цепи 100 аминокислотных остатков, число возможных вариантов может составить 10130. Многие белки велики и по длине, и по молекулярной массе.
- Инсулин –5700
- Рибонуклеаза –12700
- Альбумин-36000
- Гемоглобин-65000

- Аминокислоты (аминокарбоновые кислоты) — полярные соединения, содержащие аминогруппу ( - NH 2 ) , которая определяет свойства оснований, и карбоксильную группу ( - COOH) , обеспечивающую свойства кислоты .

Аминокислоты - амфотерные соединения , поэтому могут взаимодействовать друг с другом, образуя полипептидную цепь
- Участки молекул, лежащие вне амино- и карбоксильной групп, которыми отличаются аминокислоты, называются радикалами.

Пептидная
связь

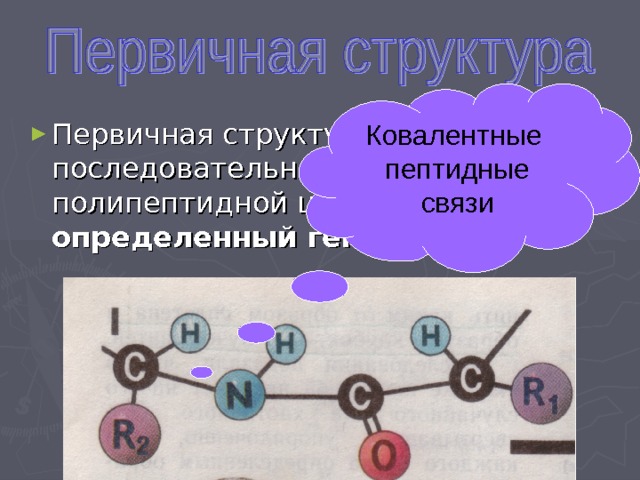
Ковалентные
пептидные связи
- Первичная структура – линейная последовательность аминокислот в полипептидной цепи, определенный генотипом .

Первичная структура белка
Тре
Ала
Вал
Ала
Ала
Ала
Глу
Сер
Гли
Сер
Глу
Первичная структура любого белка уникальна и определяет его форму, свойства и функции.

Образование пептидной связи
O
H
R
O
C
C
R
C
C
O
N
H
H
O
H
H
N
H
H
O
H
H

ПЕПТИДНАЯ СВЯЗЬ

- Вторичная структура – спираль с одинаковым расстоянием между витками.
Водородные связи между
-С=О, находящимися на
одном витке спирали, и
группами – N-H на другом
витке.
Различают 2 вида структур: -спираль, -складчатый слой. - спираль имеет спиральную конфигурацию (жесткого цилиндра) образуется водородными связями, в связях участвуют все пептидные группы СО и NH, радикалы не участвуют в образовании спирали. Спираль устойчива, высота одного витка 0,54 нм, в один виток входит 3,6 – 4 аминокислот.
_ складчатый слой имеет вид изогнутой цепи, формируется с помощью водородных связей между водородом NH и
кислородом СО-групп двух аминокислотных остатков, находящихся на большом расстоянии друг от друга. Радикалы могут располагаться как с наружной так и внутренней сторон.
Различают 2 вида структур: -спираль, -складчатый слой. -спираль имеет спиральную конфигурацию (жесткого цилиндра) образуется водородными связями, в связях участвуют
все пептидные группы СО и NH, радикалы не участвуют в образовании спирали. Спираль устойчива, высота одного витка
0,54 нм, в один виток входит 3,6 – 4 аминокислот.
-складчатый слой имеет вид изогнутой цепи, формируется с помощью водородных связей между водородом NH и
кислородом СО-групп двух аминокислотных остатков, находящихся на большом расстоянии друг от друга. Радикалы
могут располагаться как с наружной так и внутренней сторон.
Актин, миозин

- Третичная структура – клубок из полипептидной спирали .
- Водородные связи, дисульфидные мостики –S-S-, сложноэфирная связь (ионная) между радикалами. Полярные группы COOH и OH взаимодействуют с водой, а неполярные радикалы отталкивают ее, они направлены внутрь глобул.
- Радикалы взаимодействуют
между собой благодаря
силам Ван-дер-Ваальса ( гидрофильно-гидрофобных взаимодействий).
Ионные, водородные, ковалентные
(дисульфидные мостики)

Структура молекулы белка
- Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин.
- Было выявлено, что молекула инсулина состоит из двух полипептидных цепей
(21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
Дисульфидная связь

Связи, образующие третичную структуру белка
- а ) гидрофобными – неполярные радикалы собираются в группы, оттесненные молекулами воды (связь водородная между молекулами воды);
- б) ионные или солевые – между полярными радикалами;
- в) дисульфидные – между радикалами, содержащими серу (цистеин). Это прочные связи по природе ковалентные; г) Ван-дер-Ваальсовы силы – взаимодействие электрически нейтральных молекул или атомов.

- Белки волос, шерсти, кожи, сухожилий
1.фибриллярные белки – вытянутые в виде волокна, например, фиброин – белок натурального шелка; 2) мембранные белки – расположенные в мембране, например, рецепторы гармонов, натриевые и калиевые каналы,
порин, родопсин; 3) глобулярные – растворимые в воде, шаровидные .
фибриллярные белки – вытянутые в виде волокна, например, фиброин – белок натурального шелка; 2) мембранные белки – расположенные в мембране, например, рецепторы гармонов, натриевые и калиевые каналы,
порин, родопсин; 3) глобулярные – растворимые в воде, шаровидные.

- Четвертичная структура – структура из нескольких полипептидных цепей
Силы
межмолекулярного
притяжения
гемоглобин

- Четвертичная структура.
- Характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
- Глобулы удерживаются вместе благодаря ионным, гидрофильно-гидрофобным и электростатическим взаимодействиям.

- Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин .
- Он образован двумя -субъединицами (141 аминокислотный остаток) и двумя -субъединицами (146 аминокислотных остатков).С каждой субъединицей связана молекула гема, содержащая железо.

Уровни организации белковой молекулы
Структура белковой молекулы
Характеристика структуры
Первичная-линейная
Тип связи, определяющий структуру
Порядок чередования аминокислот в полипептидной цепи
Вторичная-спиральная
Ковалентная пептидная связь – NH-CO-
Закручивание полипептидной линейной цепи в спираль
Третичная-глобулярная
Внутримолекулярные водородные связи
Упаковка вторичной спирали в клубок-клубочковидная структура
Четвертичная
Ковалентные дисульфидные и ионные связи
Соединение нескольких глобул в сложный комплекс
Межмолекулярное притяжение и все другие виды связей

Свойства белков
1) амфотерность – проявляют и кислые и основные свойства 2) гидрофобность и гидрофильность 3) буферность – поддерживают концентрацию ионов водорода на постоянном уровне 4) белки способны к самосборке 5) стабильность 6) спецефичность 7) способны к обратным конформационным изменениям 8) денатурация – разрушение II, III, IV структур под действием физических и химических факторов с сохранением первичной структуры 9) ренатурация – восстановление пространственной структуры и биологической активности, если не нарушена I структура белка.

обратимая
необратимая
Свойства белков
Сократимость
Денатурация
Способность к химическим взаимодействия с другими веществами
Двигательная
Защитная
Транспортная
Каталитическая
Сигнальная
Структурная
Функции белков

Свойства белков.
- Начиная с вторичной структуры, пространственное строение (конфигурация) макромолекул белка поддерживается в основном слабыми химическими связями. Под влиянием внешних факторов (изменение температуры, солевого состава среды, PH и т.д.) слабые связи, стабилизирующие макромолекулу, рвутся и структура белка, а следовательно его свойства, изменяются.
- Процесс утраты белковой молекулой своей структурной организации называется денатурацией.

Разрушение вторичной и третичной структур под воздействием различных факторов внешней среды.
Третичная структура
Первичная структура
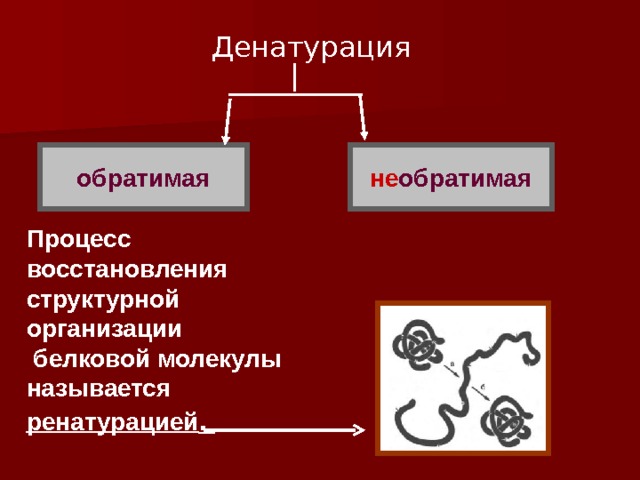
Денатурация
не обратимая
обратимая
Процесс восстановления
структурной организации
белковой молекулы
называется ренатурацией .

под воздействием высоких температур

под действием солей металлов

под действием спиртов

Под действием химических веществ – щелочей, кислот, солей тяжелых металлов, спиртов.

Белок в пищеварительной системе под воздействием соляной кислоты желудка становится нерастворим (пример с куриным яйцом), доступен действию пищеварительных ферментов.
Свёртывание крови.

- Ренатурация лежит в основе раздражимости клеток. Так под действием гормонов регулируется действие ферментов, рецепторов, транспортеров и т.д.
- Иногда денатурация белка имеет определенное значение. Например, паук выделяет капельку секрета и приклеивает ее к какой-нибудь опоре. Затем, продолжая выделять секрет, он слегка натягивает ниточку и этого слабого натяжения достаточно, чтобы белок денатурировался, из растворимой формы перешел в нерастворимую, и нить приобрела прочность.


Структурная
Каталитическая
Защитная
Транспортная
Сократительная
Сигнальная
Регуляторная
Энергетическая


Структурная
Белки участвуют в образовании всех мембранных и немембранных структур клетки, а также внеклеточных структур. У высших животных, например, из белков состоят стенки кровеносных сосудов, сухожилия, хрящи и т.д. Поэтому первая функция строительная (кератин, коллаген).
кератин
Кератин, белок, волос, перьев птиц, когтей пресмыкающихся и зверей. Коллаген – входит в состав кожи, сухожилий. Гистоны – белки ДНК.
. Структурная – кератин, белок, волос, перьев птиц, когтей пресмыкающихся и зверей. Коллаген – входит в состав сухожилий. Гистоны – белки ДНК.
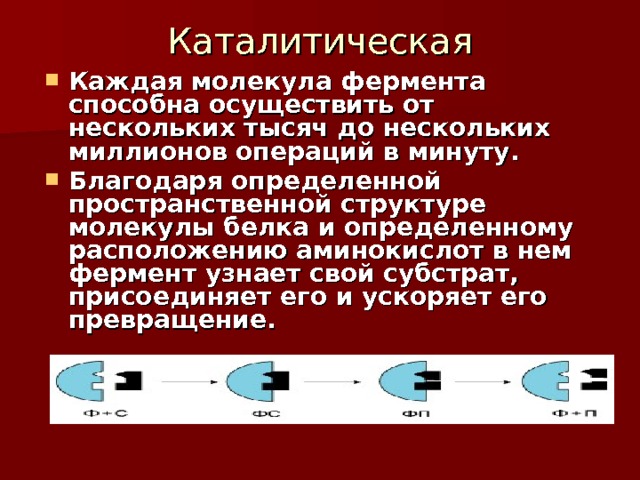
Каталитическая
- Каждая молекула фермента способна осуществить от нескольких тысяч до нескольких миллионов операций в минуту.
- Благодаря определенной пространственной структуре молекулы белка и определенному расположению аминокислот в нем фермент узнает свой субстрат, присоединяет его и ускоряет его превращение.

- В белковой молекуле есть участки, которые узнают еще и конечный продукт, сходящий с биологического конвейера. Если такого продукта слишком много, то активность самого начального фермента тормозится им, и наоборот, если продукта слишком мало, то фермент активируется. Это обратные связи, которые обеспечивают процессы саморегуляции.

родопсин, холинорецепторы
Сигнальная функция
- В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.

Двигательная функция
- Все виды движений, к которым способны клетки у высших животных, в том числе и сокращение мышц, а также мерцание ресничек, движения жгутиков выполняют особые сократительные белки (актин, миозин и др.).
. Двигательная – актин, миозин, белок мышц; тубулин образованы микротрубочкой клеток; флагмин – в состав жгутиков бактерий; динеин, кинезин – молекулярные двигатели.

Актин, миозин, белок мышц; Тубулином образованы микротрубочки клеток; Флагмин входит в состав жгутиков бактерий; Динеин, кинезин – молекулярные двигатели.

Транспортная функция
- В крови, в наружных клеточных мембранах, в цитоплазме, ядре клетки есть различные транспортные белки. Так белок крови гемоглобин присоединяет кислород и разносит его по всем тканям и органам.
Транспортная – гемоглобин – перенос О 2 и Н 2 О; ферритин – транспортирует ионы железа; транспортные белки мембран образуют ионные каналы для перемещения Na + , К + .
ферритин – транспортирует ионы железа; транспортные белки мембран образуют ионные каналы для перемещения Na + ,К + .

Защитная функция
- При введении чужеродных белков или клеток в организм в нем происходит выработка особых белков, которые связывают и обезвреживают чужеродные клетки и вещества. В лимфоидных тканях (лимфатические железы, селезенка, вилочковая железа) производятся клетки-лимфоциты, способные синтезировать огромное разнообразие защитных белков антител.
чужеродные белки
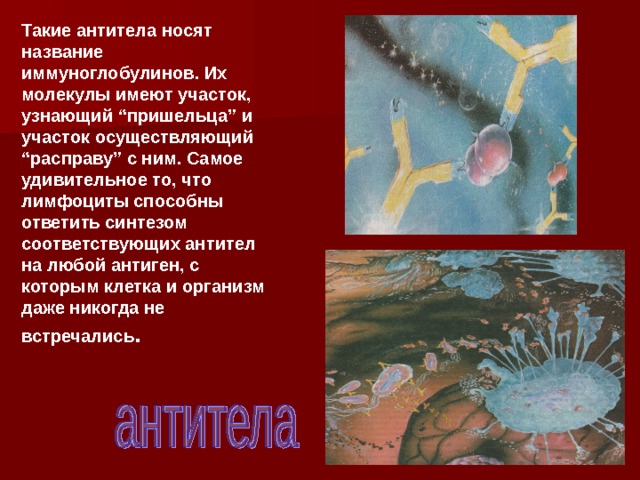
Такие антитела носят название иммуноглобулинов. Их молекулы имеют участок, узнающий “пришельца” и участок осуществляющий “расправу” с ним. Самое удивительное то, что лимфоциты способны ответить синтезом соответствующих антител на любой антиген, с которым клетка и организм даже никогда не встречались .

Например, фибриноген
и протромбин обеспечивают
свертываемость крови
Защитная – антитела, протромбин, фибриноген; лизоцим – содержащийся в слюне; муцин – в слюне и желудке.
лизоцим – содержащийся в слюне; муцин – в слюне и желудке
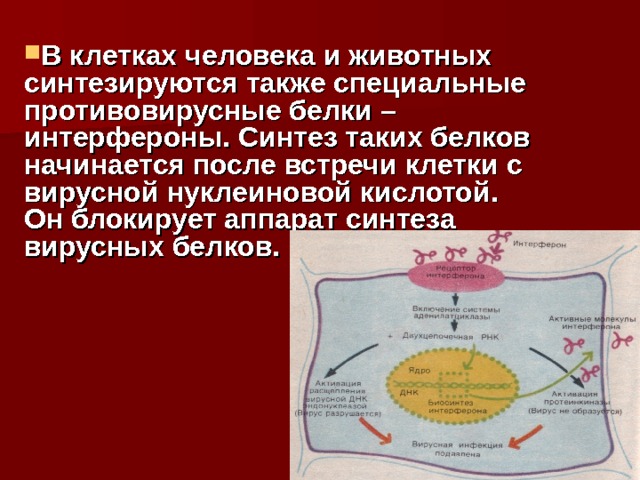
- В клетках человека и животных синтезируются также специальные противовирусные белки – интерфероны. Синтез таких белков начинается после встречи клетки с вирусной нуклеиновой кислотой. Он блокирует аппарат синтеза вирусных белков.

Регуляторная функция
- Регуляторная функция связана с регуляторами физиологических процессов – гормонами. Многие из них также по природе своей белки. Гормоны роста, адренокортикотропный, тиреотропный гормоны, инсулин, глюкагон и другие являются белками.
Например, инсулин регулирует
уровень углеводов в крови .

Энергетическая функция
- . При распаде 1 г белка до конечных продуктов выделяется около 17 кДж энергии. Однако белки используются, как источник энергии обычно, когда истощаются иные источники, такие как углеводы и жиры.

- Основные источники пищевого белка: мясо, молоко, продукты переработки зерна, хлеб, рыба, овощи.

Белковый баланс
- В зрелом возрасте у здорового человека существует азотное равновесие, т.е. количество азота, полученного с белками пищи равно количеству выделяемого азота. В молодом, растущем организме идет накопление белковой массы, поэтому азотный баланс будет положительный, т.е. количество поступающего азота превышает количество выводимого из организма. У людей пожилого возраста, а также при некоторых заболеваниях наблюдается отрицательный азотный баланс. Длительный отрицательный азотный баланс ведет к гибели организма.

- Животные и растительные белки усваиваются организмом неодинаково. Если белки молока, молочных продуктов, яиц усваиваются на 96%, мяса и рыбы – на 93–95%, то белки хлеба – на 62–86%, овощей – на 80%, картофеля и некоторых бобовых – на 70%. Однако смесь этих продуктов может быть биологически более полноценной.

- Необходимо помнить, что некоторые аминокислоты при тепловой обработке, длительном хранении продуктов могут образовывать неусвояемые организмом соединения, т.е. становиться “недоступными”. Это снижает ценность белка.
- При умеренном нагревании пищевых продуктов, особенно растительного происхождения, усвояемость белков несколько возрастает. При интенсивной тепловой обработке усвояемость снижается

Суточная потребность взрослого человека в белке разного вида.
- 1–1,5 г на 1 кг массы тела, т.е. приблизительно 85–100 г.
- Доля животных белков должна составлять приблизительно 55% от общего его количества в рационе.

Белки - это высокомолекулярные азотосодержащие органические вещества, молекулы которых построены из аминокислот. Они являются структурной и функциональной основой жизнедеятельности всех живых организмов.