
Решение заданий нового типа ЕГЭ по химии
Из опыта работы учителя химии
МБОУ «СОШ №2 г. Щигры Курской области» Ерохиной Е.Н.

Изменения в контрольно-измерительных материалах ЕГЭ по химии, представленных в демоверсии ФИПИ в 2023 году
Принятые изменения в экзаменационной работе 2023 г. ориентированы на повышение объективности проверки сформированности ряда важных общеучебных умений, в первую очередь таких:
ü как анализ текста условия задания,
ü комбинирование аналитической и расчётной деятельности,
ü анализ состава веществ и прогноз возможности протекания реакций между ними,
ü моделирование химических процессов и описание признаков их протекания и др.

ЕГЭ-2023

ЕГЭ-2023
Задание 21. Гидролиз
 7 от 6 до 8 Слабые кислоты: Н 2 SO 3 , HNO 2 , HClO 2 , Нерастворимые в воде вещества (Н 2 SiO 3 , CuS, Mg(OH) 2 и др.) HClO, Н 2 CO 3 , H 3 PO 4 , HF, H 2 S, CH 3 COOH. нейтральная от 8 до 11 слабо щелочная Cоли, образованные ионами слабого основания и сильной кислоты: NH 4 Cl, FeCl 3 , Al 2 (SO 4 ) 3, CrCl 3, FeCl 2, KAl(SO 4 ) 2 NH 4 OH (NH 3 *H2O) Cоли, образованные ионами сильного основания и сильной кислоты: КClO 3 , NaClO 4 , KMnO 4 , CaCl 2 , BaBr 2 , SrI 2 , CF 3 COOLi. и др. от 11 до 14 сильно щелочная Cоли, образованные ионами сильного основания и слабой кислоты: CH 3 COONa, Na 2 CO 3 , Na 2 S, KCN, NaНCO 3 , КАlO 2 , Na 2 ZnO 2, NaHS, Na 2 HPO 4 Cоли, образованные ионами слабого основания и слабой кислоты: CH 3 COONH 4 , (NH 4 ) 2 CO 3 , HCOONH 4 и др. Щёлочи (8) Кислые соли Спирты, фенолы, кетоны, альдегиды NaHSO4 Na[Al(OH) 4 ], Ca(ClO)Cl. NaH2PO4 Амины NaHSO3 " width="640"
7 от 6 до 8 Слабые кислоты: Н 2 SO 3 , HNO 2 , HClO 2 , Нерастворимые в воде вещества (Н 2 SiO 3 , CuS, Mg(OH) 2 и др.) HClO, Н 2 CO 3 , H 3 PO 4 , HF, H 2 S, CH 3 COOH. нейтральная от 8 до 11 слабо щелочная Cоли, образованные ионами слабого основания и сильной кислоты: NH 4 Cl, FeCl 3 , Al 2 (SO 4 ) 3, CrCl 3, FeCl 2, KAl(SO 4 ) 2 NH 4 OH (NH 3 *H2O) Cоли, образованные ионами сильного основания и сильной кислоты: КClO 3 , NaClO 4 , KMnO 4 , CaCl 2 , BaBr 2 , SrI 2 , CF 3 COOLi. и др. от 11 до 14 сильно щелочная Cоли, образованные ионами сильного основания и слабой кислоты: CH 3 COONa, Na 2 CO 3 , Na 2 S, KCN, NaНCO 3 , КАlO 2 , Na 2 ZnO 2, NaHS, Na 2 HPO 4 Cоли, образованные ионами слабого основания и слабой кислоты: CH 3 COONH 4 , (NH 4 ) 2 CO 3 , HCOONH 4 и др. Щёлочи (8) Кислые соли Спирты, фенолы, кетоны, альдегиды NaHSO4 Na[Al(OH) 4 ], Ca(ClO)Cl. NaH2PO4 Амины NaHSO3 " width="640"
рН
от 0 до 3
Сильные кислоты: Н 2 SO 4 , HNO 3 , HClO 3 , HClO 4 , HMnO 4 , HCl, HBr, HI, CF 3 COOH.
рН=7
сильно кислая
от 3 до 6 слабо кислая
рН7
от 6 до 8
Слабые кислоты: Н 2 SO 3 , HNO 2 , HClO 2 ,
Нерастворимые в воде вещества (Н 2 SiO 3 , CuS, Mg(OH) 2 и др.)
HClO, Н 2 CO 3 , H 3 PO 4 , HF, H 2 S, CH 3 COOH.
нейтральная
от 8 до 11
слабо щелочная
Cоли, образованные ионами слабого основания и сильной кислоты: NH 4 Cl, FeCl 3 , Al 2 (SO 4 ) 3, CrCl 3, FeCl 2, KAl(SO 4 ) 2
NH 4 OH (NH 3 *H2O)
Cоли, образованные ионами сильного основания и сильной кислоты: КClO 3 , NaClO 4 , KMnO 4 , CaCl 2 , BaBr 2 , SrI 2 , CF 3 COOLi. и др.
от 11 до 14
сильно щелочная
Cоли, образованные ионами сильного основания и слабой кислоты: CH 3 COONa, Na 2 CO 3 , Na 2 S, KCN, NaНCO 3 , КАlO 2 , Na 2 ZnO 2, NaHS, Na 2 HPO 4
Cоли, образованные ионами слабого основания и слабой кислоты: CH 3 COONH 4 , (NH 4 ) 2 CO 3 , HCOONH 4 и др.
Щёлочи (8)
Кислые соли
Спирты, фенолы, кетоны, альдегиды
NaHSO4
Na[Al(OH) 4 ], Ca(ClO)Cl.
NaH2PO4
Амины
NaHSO3

Ba(NO 3 ) 2
LiOH
NaHSO4
NaHS
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) Гидросульфат натрия 2) Гидросульфид калия 3) Нитрат бария 4) Гидроксид лития
Запишите номера веществ в порядке убывания значения pH их водных растворов.

ЕГЭ-2023
Задание №23
Задача относится к заданиям II (повышенного) уровня сложности
(из спецификации КИМ ЕГЭ-2023):
правильное решение задачи оценивается в 2 балла,
на это отведено 5-7 минут.
Задание ориентировано на проверку умения проводить расчёты на основе данных, отражающих изменения концентрации веществ (рассчитывать исходные и конечные равновесные концентрации участников реакции)

Демо 2023.
Пример 1. В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислород. В результате протекания обратимой реакции
2SO 2 (г) + O 2 (г)
2SO 3 (г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация оксида серы (IV) составила 0,6 моль/л, а равновесная концентрация кислорода и оксида серы (VI) – 0,3 моль/л и 0,4 моль/л соответственно. Определите равновесную концентрацию SO 2 ( X ) и исходную концентрацию O 2 ( Y ).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л 2) 0,2 моль/л 3) 0,3 моль/л
4) 0,4 моль/л 5) 0,5 моль/л 6) 0,6 моль/л

Y 0,2+0,3=0,5 моль/л
С 0 ( моль/л)
2SO 2 (г) + O 2 (г) 2SO 3 (г)
0,6
2 моль 1 моль 2 моль
С
С р
0
Y
0,4
0,4
0,2
0,4
Х
0,3
Х 0,6-0,4= 0,2 моль/л
Исходная концентрация оксида серы (IV) составила 0,6 моль/л , а равновесная концентрация кислорода и оксида серы (VI) – 0,3 моль/л и 0,4 моль/л соответственно. Определите равновесную концентрацию SO 2 ( X ) и исходную концентрацию O 2 ( Y ).
Ответ: 25

Этап 1. Подготовительный:
а) установление исходных и равновесных концентраций на основании анализа текста;
б) в нахождении "известного" вещества - по которому будут производиться стехиометрические расчеты.
Этап 2. Стехиометрические расчеты по уравнению реакции :
на основании изменения концентрации известного вещества определяют изменение концентраций неизвестных веществ.
Этап 3. Нахождение неизвестных концентраций:
ориентиром является то, что у исходных реагентов в ходе реакции происходит уменьшение концентрации, а у продуктов - увеличение.

Пример 2. В реактор постоянного объёма поместили некоторое количество азота и водорода . В результате протекания обратимой реакции
N2(г) + 3H2(г) ⇄ 2NH3(г)
в реакционной системе установилось химическое равновесие. При этом исходная концентрация водорода составила 1,2 моль/л , а равновесная концентрация азота и водорода – 0,4 моль/л и 0,3 моль/л соответственно. Определите исходную концентрацию азота (X) и равновесную концентрацию аммиака (Y) .
Выберите из списка номера правильных ответов.
1) 0,2 моль/л 2) 0,4 моль/л 3) 0,6 моль/л
4) 0,7 моль/л 5) 0,8 моль/л 6) 0,9 моль/л

Х 0,3+0,4= 0,7 моль/л
1,2
С 0 ( моль/л)
N 2 (г) + 3H 2 (г) 2NH 3 (г)
1 моль 3 моль 2 моль
С
С р
Х
0
0,6
0,3
0,9
Y
0,4
0,3
Y 0+0,6=0,6 моль/л
Ответ: 43

Пример 3. В реактор постоянного объёма поместили некоторое количество хлора и оксида азота(II). В результате протекания обратимой реакции
Cl 2 (г) + 2NO(г) ⇄ 2NOCl(г)
в реакционной системе установилось химическое равновесие. При этом равновесные концентрации хлора и оксида азота (II) составили
0,8 моль/л и 1,2 моль/л соответственно. Определите исходную концентрации Cl 2 (X) и равновесную концентрацию NOCl (Y) , если к моменту наступления равновесия прореагировало 75% оксида
азота (II).
Выберите из списка номера правильных ответов.
1) 1,3 моль/л 2) 2,6 моль/л 3) 3,6 моль/л
4) 5,2 моль/л 5) 6,5 моль/л 6) 7,2 моль/л
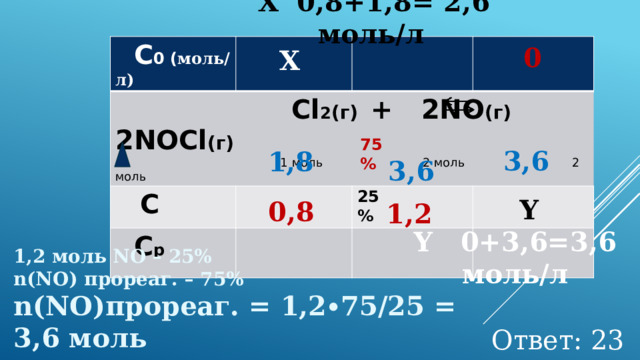
Х 0,8+1,8= 2,6 моль/л
С 0 ( моль/л)
Cl 2 (г) + 2NO (г) 2NOCl (г)
1 моль 2 моль 2 моль
С
С р
0
Х
75%
3,6
3,6
1,8
25%
Y
0,8
1,2
Y 0+3,6=3,6 моль/л
1,2 моль NO – 25%
n(NO) прореаг. – 75%
n(NO)прореаг. = 1,2∙75/25 = 3,6 моль
Ответ: 23

Пример 3. В реактор объемом 10 л поместили 8 г водорода и этилен. В результате протекания обратимой химической реакции
С2H4 (г) + H2 (г) ⇆ С2H6 (г)
в системе установилось химическое равновесие. Равновесные концентрации этана и этена составили 0,3 моль/л и 1,0 моль/л соответственно. Определите равновесную концентрацию водорода (X) и исходную концентрацию этилена (Y) .
Выберите из списка номера правильных ответов:
- 0,1 моль/л
- 0,2 моль/л
- 0,5 моль/л
- 0,7 моль/л
- 1,3 моль/л
- 1,5 моль/л

Со (Н2) = 4 : 10 = 0,4 моль/л
n(H2) = 8 : 2 = 4 моль
Y 0,3+1,0 = 1,3 моль/л
0,4
С 0 ( моль/л)
С 2 H 4 (г) + H 2 (г) С 2 H 6 (г)
1 моль 1 моль 1 моль
С
С р
Y
0
Ответ: 15
0,3
0,3
0,3
0,3
Х
1,0
X 0,4-0,3=0,1 моль/л

Задание 34. Задачи на атомистику

Смесь фосфида цинка и нитрида магния общей массой 65,7 г, в которой общее число электронов в 32 раза больше числа Авогадро, растворили в 730 г 30%-ной соляной кислоты. Вычислите массовую долю кислоты в конечном растворе.
(1) Zn₃P₂ + 6HCl = 3ZnCl₂ + 2PH₃
(2) Mg₃N₂ + 8HCl = 3MgCl₂ + 2NH₄Cl
N (ē Zn₃P₂)= 30*3+15*2 = 120 электронов
N (ē Mg₃N₂)=12*3 + 7*2 = 50 электронов
n общ. ē = N/Na = 32 моль
Пусть n(Zn₃P₂)= х моль, n(ē Zn₃P₂)= 120х моль электронов, тогда
n(Mg₃N₂)= у моль, n(ē Mg₃N₂)= 50у моль электронов. Получаем 1 уравнение:
120х + 50у = 32
m (Zn₃P₂)= 257х г, m (Mg₃N₂)= 100 у г. Второе уравнение составляем по массам веществ: 257х + 100у = 65,7
120х + 50у = 32 х = 0,1 моль
257х + 100у = 65,7 у = 0,4 моль

Смесь фосфида цинка и нитрида магния общей массой 65,7 г, в которой общее число электронов в 32 раза больше числа Авогадро, растворили в 730 г 30%-ной соляной кислоты. Вычислите массовую долю кислоты в конечном растворе.
n исх. (HCl) = 730*0,3/36,5 = 6 моль
0,1 моль 0,6 моль 0,2 моль
- Zn₃P₂ + 6HCl = 3ZnCl₂ + 2PH₃
0,4 моль 3,2 моль
(2) Mg₃N₂ + 8HCl = 3MgCl₂ + 2NH₄Cl
n(PH₃) = 2*0,1 = 0,2 моль
n прореаг. (HCl) = 6*0,1 + 8*0,4 = 3,8 моль
m(PH₃) = 0,2*34 = 6,8 г
n ост. (HCl) = 6 - 3,8 = 2,2 моль
M ост. (HCl) = 2,2*36,5 = 80,3 г
m(р-ра) = m (смеси) + m(р-ра HCl) - m(PH₃) = 65,7 + 730 - 6,8 = 788,9 г
w(HCl) = 80,3/788,9 = 0,1018 или 10,18%
![Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5 %. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе. ( 1) Zn + SnCl 2 = ZnCl 2 + Sn (2) ZnCl 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaCl Пусть n выд (Sn) = n прореаг (Zn) = x моль n ē общ. = N/Na = 56 моль nē(Sn) – nē(Zn) = nē общ. * 0,125 50х – 30х=56* 0,125 20х = 7 х=0,35 моль n прореаг. (Zn) = n выдел. (Sn) = n (ZnCl2) = 0,35 моль](https://fsd.multiurok.ru/html/2023/04/30/s_644e9692b6ec1/img19.jpg)
Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5 %. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе.
( 1) Zn + SnCl 2 = ZnCl 2 + Sn
(2) ZnCl 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaCl
Пусть n выд (Sn) = n прореаг (Zn) = x моль
n ē общ. = N/Na = 56 моль
nē(Sn) – nē(Zn) = nē общ. * 0,125
50х – 30х=56* 0,125
20х = 7
х=0,35 моль
n прореаг. (Zn) = n выдел. (Sn) = n (ZnCl2) = 0,35 моль
![Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5 %. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе. 0,35 моль 1,4 моль (2) ZnCl 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaCl m(NaOH) = mр-ра*w /100% = 480 * 0,2 = 96 г n исх. (NaOH) = m/M = 96/40 = 2,4 моль n ост.(NaOH) = n исх. - n прор. = 2,4 моль – 1,4 моль = 1 моль m ост.(NaOH) = n * M = 1 * 40 = 40 г m(р-ра) = m(р-ра SnCl 2 ) + m(Zn) - m(Sn) + m(р-ра NaOH) = 100 + 0,35 * 65 – 0,35 * 119 + 480 = 561,1 г ω ост.( NaOH) = m ост. (NaOH)* 100%/ mр-ра = 40 /561,1 * 100% = 7,13%](https://fsd.multiurok.ru/html/2023/04/30/s_644e9692b6ec1/img20.jpg)
Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5 %. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе.
0,35 моль 1,4 моль
(2) ZnCl 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaCl
m(NaOH) = mр-ра*w /100% = 480 * 0,2 = 96 г
n исх. (NaOH) = m/M = 96/40 = 2,4 моль
n ост.(NaOH) = n исх. - n прор. = 2,4 моль – 1,4 моль = 1 моль
m ост.(NaOH) = n * M = 1 * 40 = 40 г
m(р-ра) = m(р-ра SnCl 2 ) + m(Zn) - m(Sn) + m(р-ра NaOH) = 100 + 0,35 * 65 – 0,35 * 119 + 480 = 561,1 г
ω ост.( NaOH) = m ост. (NaOH)* 100%/ mр-ра = 40 /561,1 * 100% = 7,13%

Спасибо за внимание!









 7 от 6 до 8 Слабые кислоты: Н 2 SO 3 , HNO 2 , HClO 2 , Нерастворимые в воде вещества (Н 2 SiO 3 , CuS, Mg(OH) 2 и др.) HClO, Н 2 CO 3 , H 3 PO 4 , HF, H 2 S, CH 3 COOH. нейтральная от 8 до 11 слабо щелочная Cоли, образованные ионами слабого основания и сильной кислоты: NH 4 Cl, FeCl 3 , Al 2 (SO 4 ) 3, CrCl 3, FeCl 2, KAl(SO 4 ) 2 NH 4 OH (NH 3 *H2O) Cоли, образованные ионами сильного основания и сильной кислоты: КClO 3 , NaClO 4 , KMnO 4 , CaCl 2 , BaBr 2 , SrI 2 , CF 3 COOLi. и др. от 11 до 14 сильно щелочная Cоли, образованные ионами сильного основания и слабой кислоты: CH 3 COONa, Na 2 CO 3 , Na 2 S, KCN, NaНCO 3 , КАlO 2 , Na 2 ZnO 2, NaHS, Na 2 HPO 4 Cоли, образованные ионами слабого основания и слабой кислоты: CH 3 COONH 4 , (NH 4 ) 2 CO 3 , HCOONH 4 и др. Щёлочи (8) Кислые соли Спирты, фенолы, кетоны, альдегиды NaHSO4 Na[Al(OH) 4 ], Ca(ClO)Cl. NaH2PO4 Амины NaHSO3 " width="640"
7 от 6 до 8 Слабые кислоты: Н 2 SO 3 , HNO 2 , HClO 2 , Нерастворимые в воде вещества (Н 2 SiO 3 , CuS, Mg(OH) 2 и др.) HClO, Н 2 CO 3 , H 3 PO 4 , HF, H 2 S, CH 3 COOH. нейтральная от 8 до 11 слабо щелочная Cоли, образованные ионами слабого основания и сильной кислоты: NH 4 Cl, FeCl 3 , Al 2 (SO 4 ) 3, CrCl 3, FeCl 2, KAl(SO 4 ) 2 NH 4 OH (NH 3 *H2O) Cоли, образованные ионами сильного основания и сильной кислоты: КClO 3 , NaClO 4 , KMnO 4 , CaCl 2 , BaBr 2 , SrI 2 , CF 3 COOLi. и др. от 11 до 14 сильно щелочная Cоли, образованные ионами сильного основания и слабой кислоты: CH 3 COONa, Na 2 CO 3 , Na 2 S, KCN, NaНCO 3 , КАlO 2 , Na 2 ZnO 2, NaHS, Na 2 HPO 4 Cоли, образованные ионами слабого основания и слабой кислоты: CH 3 COONH 4 , (NH 4 ) 2 CO 3 , HCOONH 4 и др. Щёлочи (8) Кислые соли Спирты, фенолы, кетоны, альдегиды NaHSO4 Na[Al(OH) 4 ], Ca(ClO)Cl. NaH2PO4 Амины NaHSO3 " width="640"














![Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5 %. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе. ( 1) Zn + SnCl 2 = ZnCl 2 + Sn (2) ZnCl 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaCl Пусть n выд (Sn) = n прореаг (Zn) = x моль n ē общ. = N/Na = 56 моль nē(Sn) – nē(Zn) = nē общ. * 0,125 50х – 30х=56* 0,125 20х = 7 х=0,35 моль n прореаг. (Zn) = n выдел. (Sn) = n (ZnCl2) = 0,35 моль](https://fsd.multiurok.ru/html/2023/04/30/s_644e9692b6ec1/img19.jpg)
![Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5 %. К оставшемуся раствору добавили 480 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе. 0,35 моль 1,4 моль (2) ZnCl 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaCl m(NaOH) = mр-ра*w /100% = 480 * 0,2 = 96 г n исх. (NaOH) = m/M = 96/40 = 2,4 моль n ост.(NaOH) = n исх. - n прор. = 2,4 моль – 1,4 моль = 1 моль m ост.(NaOH) = n * M = 1 * 40 = 40 г m(р-ра) = m(р-ра SnCl 2 ) + m(Zn) - m(Sn) + m(р-ра NaOH) = 100 + 0,35 * 65 – 0,35 * 119 + 480 = 561,1 г ω ост.( NaOH) = m ост. (NaOH)* 100%/ mр-ра = 40 /561,1 * 100% = 7,13%](https://fsd.multiurok.ru/html/2023/04/30/s_644e9692b6ec1/img20.jpg)


















