Корниенко Наталья Семеновна,
учитель химии ГОУ ЛНР «Старобельская гимназия»
Урок химии, 9 класс
Тема: Реакции обмена между растворами электролитов, условия их протекания.
Цели:
1. Формирование предметных компетентностей:
1.1. рассмотреть особенности реакций обмена между растворами электролитов и условия их протекания;
1.2. углубить умение составлять ионно-молекулярные уравнения химических реакций;
1.3. совершенствовать навыки проведения химического эксперимента в соответствии с правилами техники безопасности;
развивать экспериментальные умения и исследовательские навыки;
2. Формирование ключевых компетентностей:
коммуникативные и поисковые способности, математическую грамотность, экологическую грамотность и здоровая жизнь, умение работать в парах;
3.Воспитательная: воспитать наблюдательность, целеустремленность и настойчивость.
Тип урока: приобретение новых знаний.
Методы: словесные, частично-поисковые, практические, интерактивные.
Формы работы: фронтальная беседа, работа в парах, работа обучающихся у доски, самопроверка по образцу.
Оборудование: периодическая таблица химических элементов, таблица растворимости, компьютер, виртуальная лаборатория.
Эпиграф урока: «Единственный путь, ведущий к знаниям-это деятельность»
Бернард Шоу
Ход урока:
1. Организационный момент
Добрый день! Садитесь! Я рада всех вас видеть на уроке. Сегодня мы продолжаем изучать тему " растворы. Взгляните пожалуйста на эпиграф к уроку: «Единственный путь, ведущий к знаниям-это деятельность».
Я считаю, что вы в процессе деятельности на уроке будете как всегда активными, внимательными, хорошо работать.
2. Актуализация опорных знаний:
Химическая разминка:
1. Как классифицируют вещества по электропроводности их водных растворов или расплавов?
2. Какие вещества называем электролитами?
3. Какой тип химической связи в электролитах?
4. Какие вам известны вещества электролиты?
5. Какие вещества называем неэлектролитами?
6. Какой тип связи в неэлектролитах?
7. назовите вещества-неэлектролиты?
8. Что такое электролитическая диссоциация?
9. Какие ионы образуются при электролитической диссоциации?
10. Катионы это...?
11. Анионы это...?
Тестовая работа:
1. Укажите ионы, образующиеся при диссоциации кислот:
А) катион металла; Б) катион водорода; В) гидроксид-Ион.
2. Укажите ионы, которые образуются при диссоциации щелочей:
А) катион водорода; Б) гидроксид-Ион.
3. Укажите ионы, которые образуются при диссоциации солей:
А) катион металла; Б) гидроксид-Ион; В) анион кислотного остатка;
Г) катион гидрогена.
4. В какой из указанных групп ионов находятся только катионы?
А) SO42 ─, Mg2+, OH─, K+
Б) K+, Ba2+, Fe2+, Zn2+
В) Cl─, NO3─, PO43─, SO42─
5. В результате диссоциации азотной кислоты образуются ионы:
А) K+ и NO3─ ; Б) Н+ и NO3─ ; В) Н+ и Cl─
6. В результате диссоциации хлорида бария образуются ионы:
А) Ba2+ и ОН─; Б) Ba2+ и Cl─; в) Ba2+ и 2Cl─
7. Какое из веществ в водном растворе диссоциирует с образованием гидроксид-Иона:
А) NaOH; Б) Cu (OH)2
8. Установите соответствие:
1. HCl A) 2Na++SO42─
2. K3PO4 Б) K++OH─
3. KOH В) 3K++PO43─
4. Na2SO4 Г) H++Cl─
3. Мотивация учебной деятельности:
Сегодня на уроке мы будем рассматривать условия протекания химических реакций в растворах электролитов.
Всегда ли происходят реакции обмена в растворах электролитов?
Проверим это на опытах с помощью виртуальной лаборатории
[Соблюдай правила техники безопасности при работе за компьютером!]
Работа в парах
Опыт №1
Запустить виртуальную лабораторию химия 8-11 и посмотреть видео фрагмент опыта 9.2.
К раствору серной кислоты доливаем раствор хлорида бария.
Каков признак химической реакции?
Учащиеся выбирают правильный ответ в виртуальной лаборатории.
А теперь давайте запишем в тетрадях уравнения реакции в молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной формах.
Ученики пишут уравнения у себя в тетради.
Проверьте свои уравнения в виртуальной лаборатории, нажав кнопку Проверить. Учащиеся проверяют себя с помощью правильных уравнений в виртуальной лаборатории.
А теперь давайте сделаем вывод. Реакция хлорида бария с серной кислотой сводятся к взаимодействию между катионами бария и сульфат-анионами. Учащиеся выбирают правильный ответ.
Опыт №2
В среде виртуальной лаборатории химия 8-11 посмотреть видео фрагмент опыта 9.3
К раствору карбоната натрия добавляем раствор соляной кислоты.
Каков признак химической реакции?
Учащиеся выбирают правильный ответ в виртуальной лаборатории
Запишите в тетрадях уравнения этой реакции в молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной формах.
Ученики пишут уравнения у себя в тетради и вновь проверяют свои знания в виртуальной лаборатории, нажав кнопку Проверить.
Давайте сделаем вывод из этого опыта. Ответьте на вопрос. Учащиеся выбирают правильный ответ.
Опыт №3
К раствору гидроксида натрия добавляем фенолфталеин
Затем добавляем раствор соляные кислоты
(на доске учащиеся записывают молекулярное, ионно-молекулярные уравнения реакций)
Поразмышляйте и сделайте вывод:
Образование осадка;
Выделение газа;
Образование воды.
В чем заключается суть реакций между растворами электролитов? (в связывании ионов, содержащихся в растворе, друг с другом). Это выражается записью сокращенного ионного уравнения. Реакции между растворами электролитов называются-реакциями ионного обмена.
А какое значение они имеют?
Реакции ионного обмена являются биологически важными для живых организмов.
Они постоянно происходят в растительных и животных клетках, и в организме человека. При их участии поддерживается клеточный потенциал, который проводит нервные импульсы и играет важную роль в регуляции нервной системы. Кроме того, реакции ионного обмена участвуют в обмене веществ, нарушение которого приводит к различным заболеваниям. В качестве примера рассмотрим нарушение нормы Н + желудочного сока человека. Значение РН желудочного сока в норме составляет 1,53-1,67. При уменьшении количества н+ возникает пониженная кислотность, что не способствует нормальному пищеварению пищи. По возрастанию количества н + кислотность повышается, что приводит к гастриту и язве желудка.
4. Закрепление и практическое усвоение материала.
Поразмышляй и реши
К раствору хлорида бария массой 200г с массовой долей соли 10% добавили серную кислоту. Вычислите массу вещества, выпавшего в осадок.
Найди пару
Укажите соединения, с которыми в водном растворе реагирует К2СО3
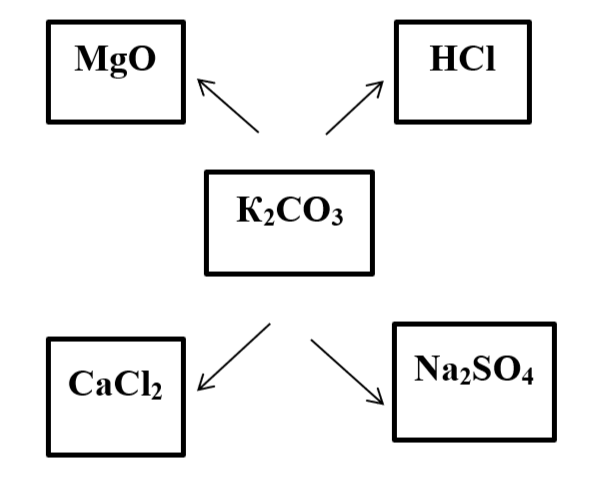
Напишите все возможные реакции ионного обмена в полной и сокращенной ионной форме.
Найдите потерянные вещества
Подобрать исходные вещества, составить уравнение в молекулярной и полной ионной формах.
Al3++PO42- → AlPO4 ↓
Ba2++SO42- → BaSO4 ↓
Завершите предложение
1. Реакции ионного обмена-это...
2.Условиями протекания реакций ионного обмена между растворами электролитов являются:…
3. Суть реакции между растворами электролитов заключается…
5. Итог урока.
Завершите предложение:
Сегодня на уроке я узнал..., мне понравилось..., интересным было…
6. Домашнее задание
Творческое задание:
Записать уравнения реакций в молекулярной и ионно-молекулярной формах по схемам:


Соль+соль …+…↓

Соль+кислота …+…+…



























