Просмотр содержимого документа
«Презентация "Уравнение состояния идеального газа"»

Урок 49. Уравнение состояния идеального газа. п.70
Клапейрон Бенуа Поль Эмиль (1799–1864 )
французский физик и инженер. Родился 26 января 1799 в Париже. Окончил Политехническую школу (1818). Работал в Институте инженеров путей сообщения в Петербурге (1820–1830). По возвращении во Францию стал профессором Школы мостов и дорог в Париже.
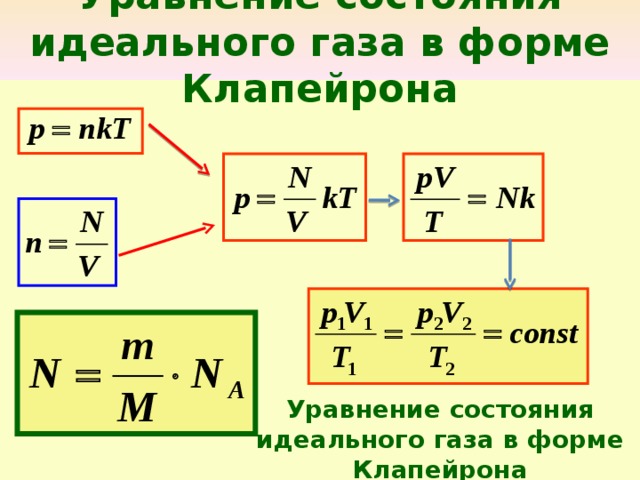
Уравнение состояния идеального газа в форме Клапейрона
Уравнение состояния идеального газа в форме Клапейрона

Менделеев Дмитрий Иванович (8.II.1834–2.II.1907)
- Обобщив уравнение Клапейрона,
в 1874 вывел общее уравнение состояния идеального газа
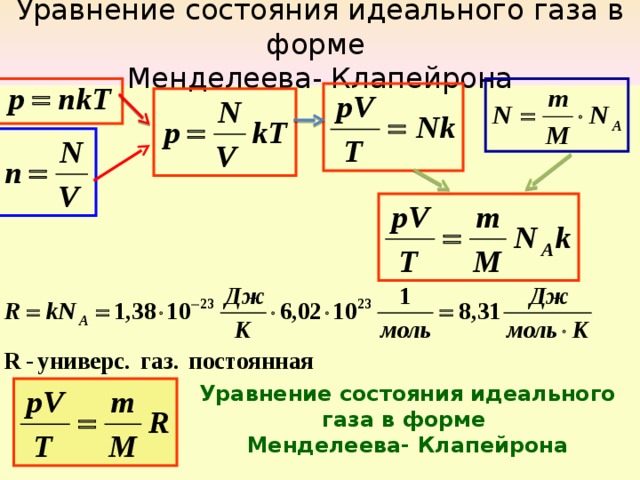
Уравнение состояния идеального газа в форме
Менделеева- Клапейрона
Уравнение состояния идеального газа в форме
Менделеева- Клапейрона

Практическое применение уравнения состояния:
1. В термометрах…
- Уравнение позволяет определить одну из величин, характеризующих состояние, если известны две другие величины
- Это используют в термометрах

2. В газовых законах…
- Зная уравнение состояния, можно сказать, как протекают в системе процессы при определённых внешних условиях

3. В молекулярной физике…
- Зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел

Df . Изотермический процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре Т= const
Закон Бойля-Мариотта:
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Э. Мариотт
Р. Бойль
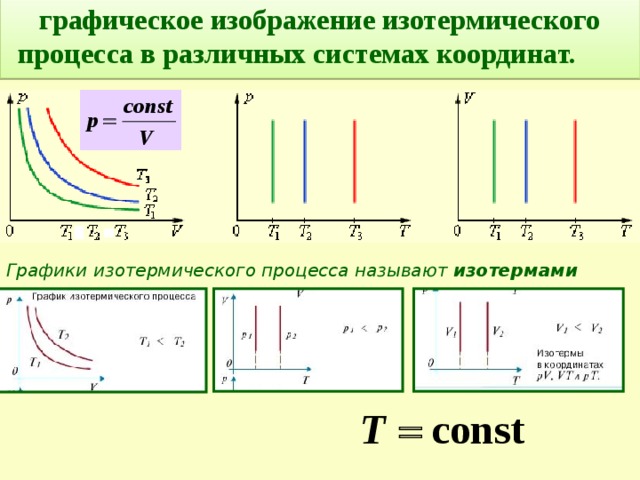
графическое изображение изотермического процесса в различных системах координат.
Графики изотермического процесса называют изотермами
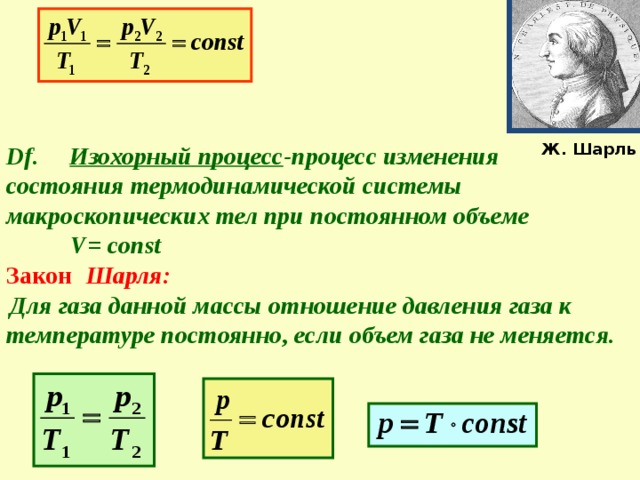
Df . Изохорный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме
V = const
Закон Шарля:
Для газа данной массы отношение давления газа к температуре постоянно, если объем газа не меняется.
Ж. Шарль
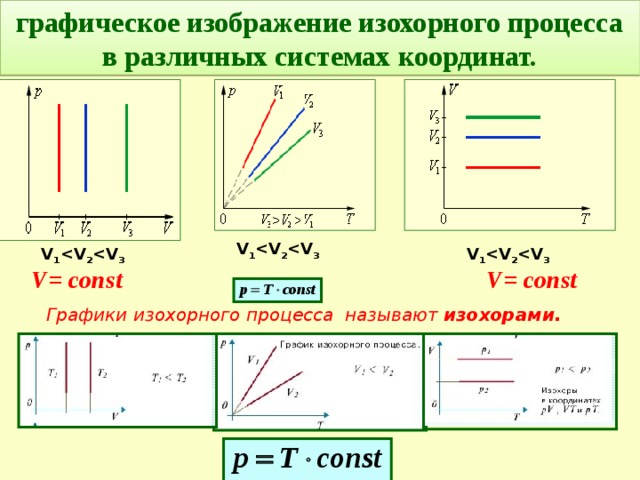
графическое изображение изохорного процесса в различных системах координат.
V 1 2 3
V 1 2 3
V 1 2 3
V = const
V = const
Графики изохорного процесса называют изохорами.

Df . Изобарный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении р= const
Закон Гей-Люссака:
Для газа данной массы отношение объема газа к абсолютной температуре постоянно, если давление газа не меняется.
Ж. Гей-Люссак
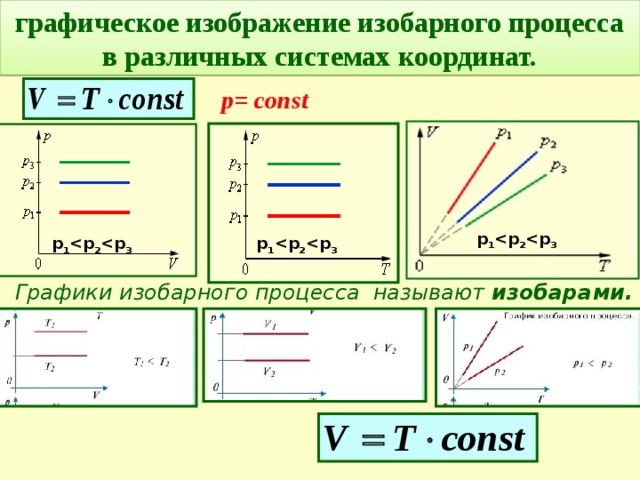
графическое изображение изобарного процесса в различных системах координат.
р= const
р 1 р 2 р 3
р 1 р 2 р 3
р 1 р 2 р 3
Графики изобарного процесса называют изобарами.

Изопроцессы в газах
Процессы, протекающие при неизменном значении
одного из параметров, называют изопроцессами .
ИЗОПРОЦЕССЫ:
Название
процесса
Изотермический
процесс
Постоянная
величина
Изобарный
процесс
T = const
Изохорный
процесс
p = const
V = const
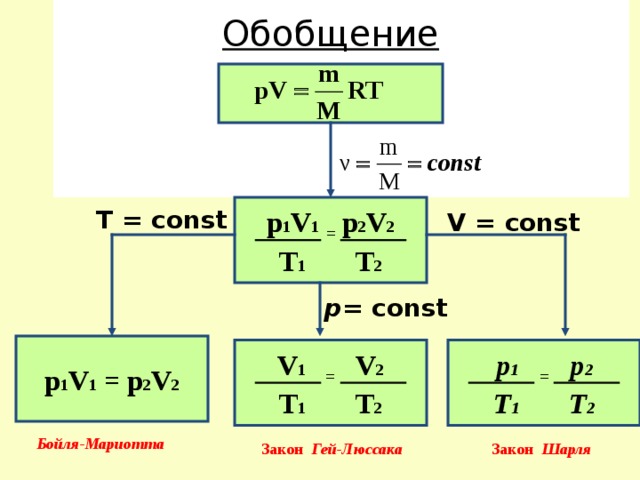
Обобщение
р 1 V 1 = р 2 V 2
T 1 T 2
T = const
V = const
р = const
р 1 V 1 = р 2 V 2
V 1 = V 2
T 1 T 2
р 1 = р 2
T 1 T 2
Бойля-Мариотта
Закон Гей-Люссака
Закон Шарля
15







































