
Уравнение состояния идеального газа

Идеальный газ —
это модель газа, удовлетворяющая следующим условиям:
1) молекулы газа можно считать МТ, которые хаотически движутся;
2) силы взаимодействия между молекулами идеального газа практически отсутствуют;
3) при столкновениях молекулы идеального газа ведут себя, как абсолютно упругие шарики.
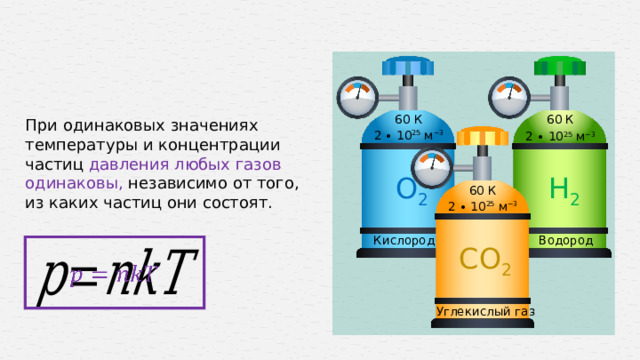
60 К
60 К
При одинаковых значениях температуры и концентрации частиц давления любых газов одинаковы, независимо от того, из каких частиц они состоят.
2 ∙ 10 25 м −3
2 ∙ 10 25 м −3
О 2
Н 2
60 К
2 ∙ 10 25 м −3
Водород
Кислород
СО 2
Углекислый газ

Давление
Объём
Абсолютная температура
Макроскопические параметры состояния идеального газа —
физические величины, которые характеризуют некоторое количество идеального газа как макроскопическую систему ().

Уравнение состояния идеального газа
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называют уравнением состояния идеального газа.
Бенуа Клапейрон
1799—1864
Дмитрий Менделеев
1834—1907

Основное уравнение МКТ:
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называется уравнением состояния идеального газа.
Концентрация:

При неизменной массе и неизменном химическом составе газа отношение произведения его давления и объёма к абсолютной температуре является величиной постоянной.
Бенуа Клапейрон
1799—1864
— уравнение Клапейрона
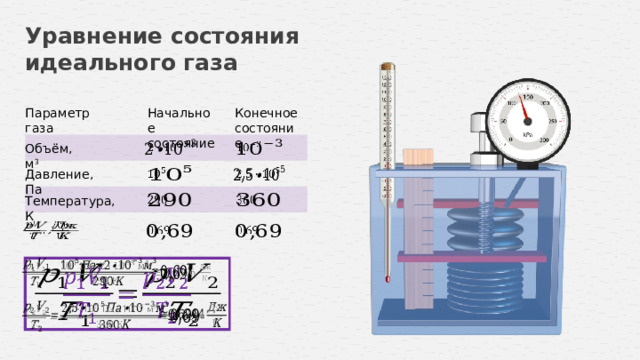
Уравнение состояния идеального газа
Параметр газа
Начальное
Конечное
состояние
состояние
Объём, м 3
Давление, Па
Температура, К

Уравнение состояния применимо
к реальным газам, если:
1) давление газа таково, что собственный объём всех молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2) температура газа такова, что значение Е п межмолекулярного взаимодействия пренебрежимо мало по сравнению с Е к теплового движения молекул.

Уравнение состояния идеального газа
Основное уравнение МКТ:
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называется уравнением состояния идеального газа.
Количество вещества:

Уравнение состояния идеального газа
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называют уравнением состояния идеального газа.
Дмитрий Менделеев
1834—1907
— уравнение Клапейрона — Менделеева

Закон Авогадро
При равных давлениях и температурах
в одинаковых объёмах любых газов содержится одинаковое число молекул.
Амедео Авогадро
1776—1856

Общее число частиц газов:
Уравнения состояния:
Парциальное давление —
давление газа, входящего в состав газовой смеси, если бы он один занимал весь объём, предоставленный смеси, при той же температуре.

Закон Дальтона
Давление смеси химически не реагирующих между собой газов равно сумме парциальных давлений каждого из газов.
Джон Дальтон
1766—1844

Задача 1.
Баллон вместимостью 20 л, содержащий газ при давлении 3 МПа и температуре 320 К, соединили с пустым баллоном вместимостью 5 л. Определите давление газа, которое установилось в баллонах после расширения, если температура газа стала равной 285 К.
ДАНО
РЕШЕНИЕ
Уравнение Клапейрона:
Конечный объём газа:
Конечное давление газа:
ОТВЕТ: давление газа в баллонах равно 2 МПа.

Задача 2. Определите плотность смеси, состоящей из 4 г водорода и 32 г кислорода при температуре 7 о С и давлении 95 кПа.
ДАНО
РЕШЕНИЕ
Плотность смеси:
Масса смеси:
Уравнение Клапейрона — Менделеева:
Закон Дальтона:
Объём смеси:

Задача 2. Определите плотность смеси, состоящей из 4 г водорода и 32 г кислорода при температуре 7 о С и давлении 95 кПа.
РЕШЕНИЕ
ДАНО
Плотность смеси:
Плотность смеси:
Масса смеси:
Масса смеси:
Уравнение Клапейрона — Менделеева:
Объём смеси:
Закон Дальтона:
Объём смеси:
ОТВЕТ: плотность смеси равна 0,49 кг/м 3 .
17

Уравнение состояния идеального газа
Уравнение, связывающее температуру, давление и объем идеального газа в состоянии теплового равновесия, называют уравнением состояния идеального газа.
Дмитрий Менделеев
1834—1907
17

Изопроцессы
Изотермический
( Т = const)
Изобарный
( p = const)
Изохорный
( V = const)
19











































