
Получение кислорода

Кислород – это вещество, вокруг которого вращается земная химия
Я. Берцелиус

Цель урока
- Рассмотреть способы получения кислорода
- Познакомиться с понятием «катализатор»

Вместо … вставьте соответствующее слово
- … - самый распространенный элемент земной коры.
2. Молекула простого вещества озона образована элементом …
3. В воздухе содержится 21% …
4. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является …
5. В состав воды входят два атома водорода и один атом …



При изучении этой темы
- вы узнаете , какие вещества и химические реакции используются для получения кислорода;
- научитесь записывать соответствующие уравнения реакций;
- научитесь получать кислород и доказывать его наличие
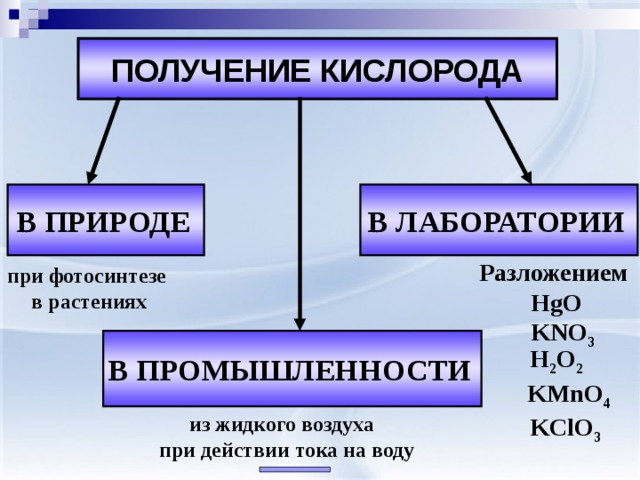
ПОЛУЧЕНИЕ КИСЛОРОДА
В ПРИРОДЕ
В ЛАБОРАТОРИИ
Разложением
НgO
KNO 3
при фотосинтезе
в растениях
В ПРОМЫШЛЕННОСТИ
H 2 O 2
KMnO 4
KClO 3
из жидкого воздуха
при действии тока на воду


Получение кислорода
I. Промышленные способы:
- Разделение воздуха на составные части
- Электролиз воды:
2 H 2 O = 2 H 2 ↑ + O 2 ↑
II. Лабораторные способы:
- Разложение пероксида водорода:
2. Разложение перманганата калия :
3. Разложение хлората калия (бертолетовой соли):
2 H 2 O 2 = 2 H 2 O + O 2 ↑
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑
2 KClO 3 = 2 KCl + 3 O 2 ↑
22.01.18
Алферова М.В.

Джозеф Пристли
(английский ученый) в 1774 году разложением оксида ртути (II) открыл кислород и изучил его свойства.
2 HgO = 2Hg + O 2
оксид ртуть кислород
ртути
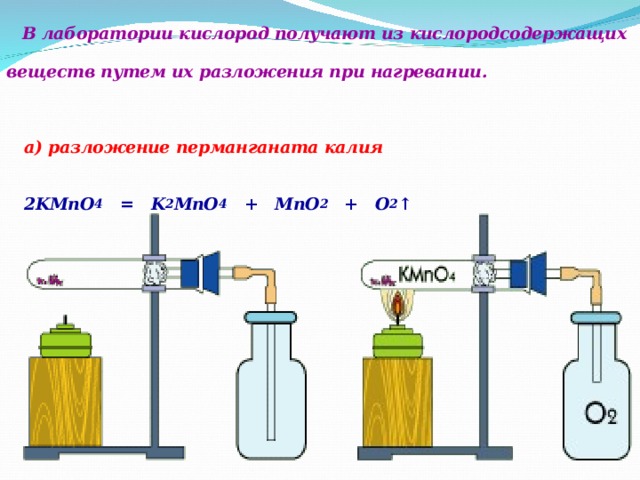
В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании.
а) разложение перманганата калия
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑
 2 Н 2 О + О 2 ↑ пероксид вода кислород водорода MnO 2 2КСlО 3 ----------- 2КСl + 3O 2 ↑ хлорат хлорид кислород калия калия Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы " width="640"
2 Н 2 О + О 2 ↑ пероксид вода кислород водорода MnO 2 2КСlО 3 ----------- 2КСl + 3O 2 ↑ хлорат хлорид кислород калия калия Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы " width="640"
MnO 2 2 Н 2 О 2 ---------- 2 Н 2 О + О 2 ↑ пероксид вода кислород водорода
MnO 2
2КСlО 3 ----------- 2КСl + 3O 2 ↑
хлорат хлорид кислород
калия калия
Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы

MnO 2 – катализатор
ускоряет химическую реакцию,
но сам при этом не расходуется

Собирание кислорода
Метод вытеснения воды
Метод вытеснения воздуха
22.01.18
Алферова М.В.

Практическая работа
Цель: получить кислород из раствора перекиси водорода, используя в качестве катализатора оксид марганца (IV), и распознать его.
Оборудование: колба, спиртовка, спички, лучина.
Реактивы: перекись водорода Н 2 О 2, оксид марганца (IV) MnO 2

Этапы эксперимента:
- Возьмите пробирку с черным порошком оксида марганца (IV) добавьте пероксид водорода. Что наблюдаете?
- Зажгите лучину, дождитесь пока на ее конце не появится тлеющий уголек и потушите её.
- Медленно внесите тлеющую лучину в пробирку с предполагаемым кислородом. Что наблюдаете?
- Составьте уравнение проделанной реакции.
- Напишите вывод.

ВЫВОД
- Мы сегодня научились получать О 2 в лабораторных условиях с помощью реакции каталитического разложения пероксида водорода и доказали наличие О 2 тлеющей лучиной.

№
Вопрос
1
Химический элемент, имеющий относительную массу 16?
2
Первая буква слова ответа
Назовите имя Лавуазье?
3
Какой физический параметр необходим для разложения КМnО 4 ?
4
Как называются частицы, образующие молекулу кислорода?
5
Где можно получить кислород, кроме промышленности?
6
Как называется газ, не поддерживающий горения, по теории Флогистона?
7
Какое физическое свойство имеет озон, но это же свойство не имеет кислород?
8
Какого газа больше в атмосфере, чем кислород?
9
Какую лучину используют для определения кислорода?
10
Как на латинском языке называется кислород?
11
Какой тип реакции необходим для получения кислорода из бертолетовой соли, перманганата калия и др.?

№
1
Вопрос
Химический элемент, имеющий относительную массу 16?(Кислород)
2
Первая буква слова ответа
Назовите имя Лавуазье? (Антуан)
3
К
Какой физический параметр необходим для разложения КМnО 4 ? (Температура)
А
4
5
Т
Как называются частицы, образующие молекулу кислорода? (Атомы)
6
Где можно получить кислород, кроме промышленности? (Лаборатория)
А
Как называется газ, не поддерживающий горения, по теории Флогистона? (Испорченный)
7
Л
Какое физическое свойство имеет озон, но это же свойство не имеет кислород? (Запах)
8
И
Какого газа больше в атмосфере, чем кислород? (Азот)
З
9
10
А
Какую лучину используют для определения кислорода? (Тлеющую)
Как на латинском языке называется кислород? (Оксигениум)
11
Т
Какой тип реакции необходим для получения кислорода из бертолетовой соли, перманганата калия и др.? (Разложение)
О
Р

ИТОГ УРОКА
- кислород можно получить в природе, промышленности и лаборатории.
- Для получения кислорода используют реакции разложения кислородсодержащих веществ.
- Реакции протекают при нагревании или в присутствии катализатора.

Рефлексивный экран
Сегодня я узнал(а) …
Было трудно …
Теперь я могу …
Я понял, что …
У меня получилось ..
Было интересно …
Меня удивило …
Мне захотелось …

Домашнее задание
- 1)Обязательное задание:
- Параграф № 22. № 1, 6 (а,б).

Индивидуальные творческие задания
Задание № 1.
Расскажите своему другу, который отсутствовал на уроке изучения темы “Получение кислорода”, используя знания о стилях речи, полученные на уроках русского языка.
Задание № 2.
Подготовить выступление для школьной конференции на тему “История открытия кислорода”, используя знания о стилях речи, полученные на уроках русского языка.
Задание №3
Сочините стихи или песню о кислороде, изобразите в рисунках его использование и значение, придумайте загадки, шарады или ребусы о кислороде.

СПАСИБО ЗА ВНИМАНИЕ


















 2 Н 2 О + О 2 ↑ пероксид вода кислород водорода MnO 2 2КСlО 3 ----------- 2КСl + 3O 2 ↑ хлорат хлорид кислород калия калия Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы " width="640"
2 Н 2 О + О 2 ↑ пероксид вода кислород водорода MnO 2 2КСlО 3 ----------- 2КСl + 3O 2 ↑ хлорат хлорид кислород калия калия Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы " width="640"































