Урок в 11 классе
по химии
«Строение атома».
Кузнецова Екатерина Владимировна
Цели урока: Познакомиться с историей развития представлений о строении атома, моделями атома, доказательствами сложности строения атома. Рассмотреть строение ядра и электронные конфигурации атома.
Задачи:
образовательные: знакомство с историей развития представлений о строении атомов, открытия и доказательства сложности строения атома на основе межпредметных связей с физикой; повторение умения составлять электронные и электронно-графические формулы атомов.
развивающие: совершенствование умения краткого изложения полученной информации, выбора из сказанного главного; формирование умения анализировать, выявлять причинно-следственные связи, оценивать свои знания.
воспитательные: развитие умения работать в коллективе.
Ход урока:
Организационный момент. Инструктаж по технике безопасности в кабинете химии ( повторный вводный).
Введение в тему урока:
1)Развитие представлений о строении атома.
Понятие атом (греч. «atomos» – неделимый) ввел Демокрит. У Демокрита атомы выступают в роли первоначала. Они неделимы, различаются по величине, весу, форме и находятся в вечном движении. После Демокрита учение об атомах было на много веков забыто. Возродил атомистическую теорию английский физик и химик Джон Дальтон. Он основывался на открытых в то время законах химии и экспериментальных данных о строении вещества. Таким образом, установил, что атомы одного элемента имеют одинаковые свойства, а разных элементов – различаются по свойствам. Дальтон ввел важную характеристику атома – атомную массу и для очень многих элементов были установлены ее относительные значения. В своем атомно-молекулярном учении Дальтон дает характеристику атому: «Атом неделим, вечен и неразрушим».
2) Атом делим, как доказали следующие экспериментальные открытия, сделанные в науке на рубеже конца 19-начала 20 века.
В 1897 году Крукс открыл катодные лучи, представляющие собой поток электронов в вакуумной трубке, содержащей катод и анод. Английский физик Джозеф Томпсон назвал частицы катодных лучей электронами.
Русский ученый Столетов открыл явление фотоэффекта – испускания металлом электронов под действием падающего на него света.
Значимым стало открытие Рентгеном «Х»-лучей, позже названных рентгеновскими в честь ученого. Эти лучи представляют собой электромагнитное излучение подобное свету с гораздо более высокой частотой, испускаемой при действии на них катодных лучей.
Большой вклад в развитие представлений об элементарных частицах внесли французский физик Антуан Анри Беккерель и супруги Кюри, открыв явление радиоактивности. Радиоактивность – это явление самопроизвольного превращения одного химического элемента в другой, сопровождаемое испусканием электронов или других частиц и рентгеновского излучения.
Эти экспериментальные данные свидетельствуют о том, что атом – сложноустроенная система.
3)Модели атома.
Одной из первых моделей строения атома явилась модель английского физика Джозефа Томсона, предложенная им в в1904 г. – так называемый «пудинг с изюмом»: атом представляет собой сферу положительного электричества с вкрапленными электронами.
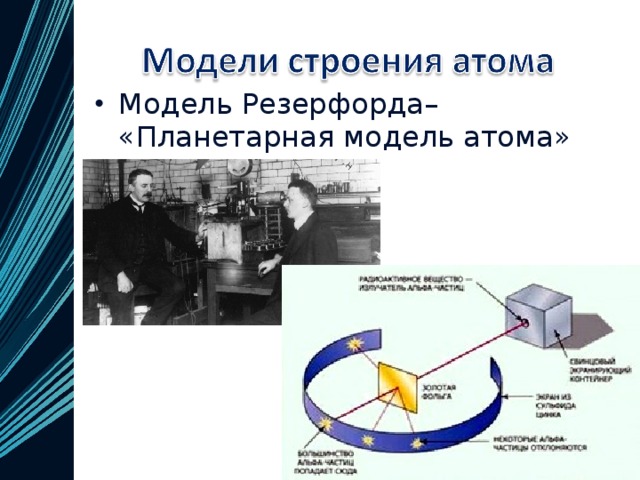
Для проверки этой модели в 1899-1911 гг. английский физик Эрнест Резерфорд провел опытные исследования и сформулировал планетарную (ядерную) теорию строения атома. Согласно этой модели, в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100’000 раз меньше размеров самого атома. В ядре сосредоточена практически вся масса атома. Оно имеет положительный заряд. Вокруг ядра движутся электроны, заряженные отрицательно. Их число определяется зарядом ядра.
Однако такая модель имела свои недостатки:
1. Резерфорд не смог объяснить устойчивости атома. Двигаясь вокруг ядра, электрон расходует энергию и в какой-то момент, израсходовав ее всю, он должен остановиться – упасть на ядро, что равносильно гибели атома. Но на самом деле атомы – структуры довольно стабильные.
2. Резерфорд не смог объяснить линейный характер атомных спектров. Согласно его модели, электрон должен излучать энергию постоянно и поэтому атомный спектр должен быть сплошным, но экспериментальные данные доказывали обратное: спектр не сплошной, а прерывистый. Это означает, что электрон излучает энергию порциями.
Свою теорию строения атома, основанную на планетарной модели и квантовой теории, в 1913 году предложил датский физик Нильс Бор. Основные положения он сформулировал в виде постулатов:
I. Электрон может вращаться вокруг ядра по определенным, стационарным круговым орбиталям.
II. Двигаясь по стационарной орбите, электрон не излучает энергию.
III. Излучение электромагнитной энергии (либо ее поглощение) происходит при переходе электрона с одной стационарной орбиты на другую.
Но и эта модель не явилась совершенством, в ней также присутствовали противоречия. «Спасти» теорию Бора пытались многие ученые.
В 1932 году Иваненко предложил протонно-нейтронную модель ядра. Эту теорию развил Гейзенберг. Эта модель строения атома существует до сих пор, сочетает в себе все предыдущие модели и «исправляет» их недостатки. Суть теории в том, что атомное ядро состоит из протонов и нейтронов. В совокупности они называются нуклоны. Число протонов в ядре («+» заряд) характеризует его заряд. Количество электронов («-» заряд), движущихся вокруг ядра, соответствует количеству протонов в нем. Электроны движутся по определенным атомным орбиталям, которые могут существовать в различных формах. При переходе с орбитали на орбиталь испускается или поглощается электромагнитная энергия.
4)Основные характеристики нуклонов и электрона. Массовое число. Изотопы.
5) Электронное облако.
3.Закрепление материала осуществляется поэтапно.
1.Определите число протонов и нейтронов в ядрах атомов 40Ca, 35Cl, 127I.
2. В электронной оболочке атома 19 электронов. О каком элементе идет речь? Определите число протонов и нейтронов в атомном ядре этого элемента.
3.Какими величинами характеризуется изотоп?
4. Почему изотопы одного элемента имеют разные массовые числа?
5.Почему в периодической системе у химических элементов указаны дробные значения относительной атомной массы?
6.Запишите электронные конфигурации атомов элементов, имеющих порядковые
номера 6,15,20,25. К каким электронным семействам относят эти элементы?
4.Подведение итогов урока. Рефлексия.
5. Постановка домашнего задания.
Литература:
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2013.
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская – М., 2004.







 Цели урока: Познакомиться с историей развития представлений о строении атома, моделями атома, доказательствами сложности строения атома. Рассмотреть строение ядра и электронные конфигурации атома. Задачи урока: образовательные: знакомство с историей развития представлений о строении атомов, открытия и доказательства сложности строения атома на основе межпредметных связей с физикой; повторение умения составлять электронные и электронно-графические формулы атомов. развивающие: совершенствование умения краткого изложения полученной информации, выбора из сказанного главного; формирование умения анализировать, выявлять причинно-следственные связи, оценивать свои знания. воспитательные: развитие умения работать в коллективе.
Цели урока: Познакомиться с историей развития представлений о строении атома, моделями атома, доказательствами сложности строения атома. Рассмотреть строение ядра и электронные конфигурации атома. Задачи урока: образовательные: знакомство с историей развития представлений о строении атомов, открытия и доказательства сложности строения атома на основе межпредметных связей с физикой; повторение умения составлять электронные и электронно-графические формулы атомов. развивающие: совершенствование умения краткого изложения полученной информации, выбора из сказанного главного; формирование умения анализировать, выявлять причинно-следственные связи, оценивать свои знания. воспитательные: развитие умения работать в коллективе.